
题目列表(包括答案和解析)
H、C、N、O、都属于自然界中常见非金属元素。
(1)O、C、N三种元素的第一电离能由小到大顺序是 ;NH4+中氮原子轨道的杂化类型为________。
 (2)CO、N2的结构可表示为:
(2)CO、N2的结构可表示为:
两者的键能数据:(单位kJ/mol)
|
|
A—B |
A=B |
|
|
CO |
357.7 |
798.9 |
1071.9 |
|
N2 |
154.8 |
418.4 |
941.7 |
结合数据说明CO比N2活泼的原因 。
(3)乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
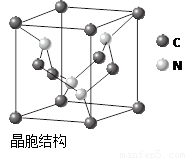
(4)C、N元素形成的新材料具有如图所示结构,该晶体硬度将超过目前世界上最硬的金刚石,成为首屈一指的超硬新材料。 该物质的化学式为: 。
H—H键的键能是436 kJ·mol -1,I—I键的键能是151kJ·mol -1,H—I键的键能是299kJ·mol -1。则对反应H2(g)+I2(g) 2HI(g)的说法,不正确的是 ( )
A.吸热反应 B.放热反应 C.化合反应 D.可逆反应
请完成下列问题(以化学式表示物质或离子):
(1)①298 K时,1 g X气体充分燃烧生成稳定的物质(C元素的单质)放出18.6 kJ的热量,写出该反应的热化学方程式:_______________________________。
②把一定量的X气体和C元素的最高价氧化物对应的水化物Z混合溶于水中,溶液中c(H+)=c(OH-),则X和Z的物质的量之比n(X)∶n(Z)________________。
A.等于1 B.大于1 C.小于1
③以化合物B4A10为燃料,以D元素的单质为助燃剂,以KOH溶液为电解质溶液构成的燃料电池中,负极的电极反应式为_______________________________。
(2)镧系元素在元素周期表的第_______族,镧系元素也叫“稀土”元素,在材料领域应用广泛,我国是“稀土金属”储量丰富的国家之一,铈(Ce)是一种稀土金属,其化合价有+2和+4价,+4价不如+2价稳定,请写出Ce(SO4)2溶液和Na2SO3在稀H2SO4中发生氧化还原反应的离子方程式_______________________________。
A、B、C、D四种短周期元素,原子序数依次增大;A和C形成一种分子X和一种+1价离子Y,X和Y在水溶液中的酸碱性正好相反;B元素的原子最外层电子数是次外层电子数的2倍,而D元素的原子次外层电子数是最外层电子数的![]() 。
。
请完成下列问题(以化学式表示物质或离子):
(1)①298 K时,1 g X气体充分燃烧生成稳定的物质(C元素的单质)放出18.6 kJ的热量,写出该反应的热化学方程式:_______________________________。
②把一定量的X气体和C元素的最高价氧化物对应的水化物Z混合溶于水中,溶液中c(H+)=c(OH-),则X和Z的物质的量之比n(X)∶n(Z)________________。
A.等于1 B.大于1 C.小于1
③以化合物B4A10为燃料,以D元素的单质为助燃剂,以KOH溶液为电解质溶液构成的燃料电池中,负极的电极反应式为_______________________________。
(2)镧系元素在元素周期表的第_______族,镧系元素也叫“稀土”元素,在材料领域应用广泛,我国是“稀土金属”储量丰富的国家之一,铈(Ce)是一种稀土金属,其化合价有+2和+4价,+4价不如+2价稳定,请写出Ce(SO4)2溶液和Na2SO3在稀H2SO4中发生氧化还原反应的离子方程式_______________________________。
已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体,C的浓溶液在加热时才与D反应。根据下列框图所示,试回答:

(1)写出化学式:A____________;E______________;L______________。
(2)反应①的离子方程式:___________________________________。
(3)反应②,工业上采取的反应条件是________________________。
(4)反应③,工业上采取的操作不是K直接与H反应,原因是__________________。
(5)每生成1 mol K,反应放出98.3 kJ热量,该反应的热化学方程式为:
___________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com