
题目列表(包括答案和解析)
下列各组物质中,所含分子数相同的是( )。
| A.10 g H2和10 g O2 |
| B.5.6 L N2(标准状况)和44 g CO2 |
| C.9 g H2O和0.5 mol Br2 |
| D.224 mL H2(标准状况)和0.1 mol N2 |
短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为 ;W的电子式 。
(2)已知:①2E → E-E;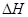 =-a kJ·mol-1 ② 2A → A-A;
=-a kJ·mol-1 ② 2A → A-A;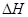 =-b kJ·mol-1
=-b kJ·mol-1
③E+A → A-E;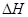 =-c kJ·mol-1
=-c kJ·mol-1
写出298K时,A2与E2反应的热化学方程式 。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);
X(g);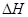 =-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | 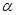 1 1 | 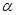 2 2 | 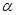 3 3 |
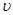 ( A2)为 。
( A2)为 。
A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大。A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4; G+的M层电子全充满。用化学式或化学符号回答下列问题:

(1)G的基态原子的外围电子排布式为 ,周期表中F属于 区。
(2)B与F形成的一种非极性分子的电子式为 ;F的一种具有强还原性的氧化物分子的VSEPR模型为
(3)BD2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于_______
(选填“分子”、“原子”、“离子”或“金属”)晶体
(4)设C元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3种溶液:①pH=11的甲的水溶液 ②pH=3的乙的水溶液 ③pH=3的丙溶液,3种溶液中水电离出的cH+之比为
(5)丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1:4混合后,溶液中各离子浓度大小顺序为
(6)A和C形成的某种氯化物CA2Cl可作杀菌剂,其原理为CA2Cl遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl与水反应的化学方程式:___________________________
(7)往G的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是___ __
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X的元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂。E有“生物金属”之称,E![]() 离子和氩原子的核外电子排布相同。
离子和氩原子的核外电子排布相同。
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为 。
 (2)下列叙述正确的是 。(填字母)
(2)下列叙述正确的是 。(填字母)
a.M与水分子间能形成氢键,N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个![]() 键和1个
键和1个![]() 键
键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
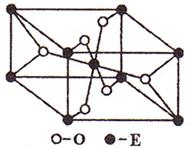
(3)E的一种氧化物Q,其晶胞结构如右上图所示,则Q的化学式为 ,该晶体中氧的配位数为 。
(4)电镀厂排放的废水中常含有剧毒的BC![]() 离子,可在Q的催化下,先用NaClO将 BC
离子,可在Q的催化下,先用NaClO将 BC![]() 氧化成BCD
氧化成BCD![]() ,再在酸性条件下BCD
,再在酸性条件下BCD![]() 继续被NaClO氧化成C2和BD2。
继续被NaClO氧化成C2和BD2。
① A、B、C、D四种元素的电负性由小到大的顺序为 。
② 与BCD![]() 互为等电子体的分子、离子的化学式依次为 (各写1种)。
互为等电子体的分子、离子的化学式依次为 (各写1种)。
③ 上述反应中后一步反应的离子方程式是 。
(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3?6H20的绿色晶体,该晶体中两舞更体的物质的量之比为1:5,则该配离子的化学式为 。
A、B、C、D、E、F是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:

⑴写出F的基态原子核外电子排布式:__________________。
⑵C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是_________
___________________________________。
⑶由A、B、D三种元素形成的一种物质俗称光气,分子中A原子采取sp2杂化成键。光气分子的结构式是___________,其中碳氧原子之间共价键是_____(填序号):
a.2个σ键 b.2个π键 c.1个σ键、1个π键
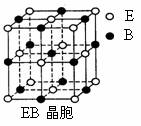
⑷EB晶胞如下图所示,EB晶体中E2+的配位数为_____,EB晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:EB-3401kJ/mol、NaCl-786kJ/mol。导致两者晶格能差异的主要原因是______________________________________________。
⑸现有含F的两种颜色的晶体,一种为紫色,另一为绿色,它们都是配位数为6的配合物(配离子难电离)。相关实验证明,两种晶体的组成皆为FD3?6H2O。为测定这两种晶体的化学式,取等质量的两种晶体分别配成待测溶液,各滴入足量的AgNO3(aq),原绿色晶体的水溶液得到白色沉淀的质量为紫色晶体的水溶液得到白色沉淀质量的2/3 。则紫色晶体配合物的化学式为________________,绿色晶体中含有化学键类型是_______________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com