
题目列表(包括答案和解析)
(1)CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的CuSO4·5H2O与H2O的质量之比。
(2)准确称取所制备的0.250 0 g CuCl样品置于一定量的0.5 mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.100 0 mol·L-1的Ce(SO4)2溶液滴定到终点,消耗24.60 mL Ce (SO4)2溶液。有关化学反应为:
Fe3+CuCl====Fe2++Cu2++Cl-
Ce4++Fe2+====Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
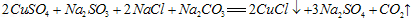
 溶液,试计算配制该溶液所需的
溶液,试计算配制该溶液所需的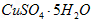 与
与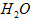 的质量之比。
的质量之比。 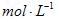
 溶液中,待样品完全溶解后,加水20 mL,用0.1000
溶液中,待样品完全溶解后,加水20 mL,用0.1000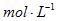
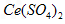 溶液滴定到终点,消耗24.60 mL
溶液滴定到终点,消耗24.60 mL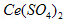 溶液。有关反应的离子方程式为:
溶液。有关反应的离子方程式为: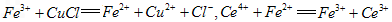 通过计算说明上述样品中CuCl的质量分数是否符合标准。
通过计算说明上述样品中CuCl的质量分数是否符合标准。 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com