
题目列表(包括答案和解析)
| A、2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1);△H=-57.3 kJ?mol-1 | B、KOH(aq)+HAc(aq)=KAc (aq)+H2O(l);△H=-57.3 kJ?mol-1 | C、C8H18(l)+12.5O2 (g)=8CO2 (g)+9H2O(l);△H=-5518 kJ?mol-1 | D、CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H═-533KJ?mol-1 |
(6分)(1)某学生进行中和热测定,取用50 mL 0.50 mol·L-1的HCl和50 mL 0.55 mol·L-1 的NaOH溶液(密度都是1 g·cm-3)。实验后得到以下数据:
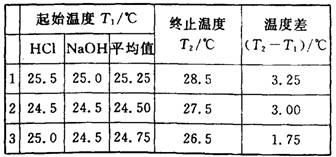
(中和后生成的溶液的比热容为4.18J·g-1·℃-1)请替该同学计算出中和热的平均值: .
(2)该学生测得的数据比理论值 (填“高”或“低”).
(3)从下列分析中选出该学生产生实验误差的原因可能是(填写字母) .
A.溶液混合后未及时盖好量热计杯盖
B.倾倒溶液太快,有少量溅出烧杯
C.溶液混合后搅拌不够
D.未等温度升到最高值就记录温度计示数
E.用量筒量取盐酸体积时仰视读数
F.烧杯和玻璃棒吸收了一部分热量
(6分)(1)某学生进行中和热测定,取用50 mL 0.50 mol·L-1的HCl和50 mL 0.55 mol·L-1的NaOH溶液(密度都是1 g·cm-3)。实验后得到以下数据: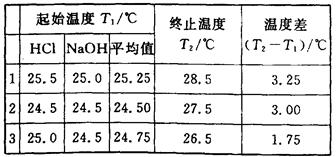
(中和后生成的溶液的比热容为4.18J·g-1·℃-1)请替该同学计算出中和热的平均值: .
(2)该学生测得的数据比理论值 (填“高”或“低”).
(3)从下列分析中选出该学生产生实验误差的原因可能是(填写字母) .
| A.溶液混合后未及时盖好量热计杯盖 |
| B.倾倒溶液太快,有少量溅出烧杯 |
| C.溶液混合后搅拌不够 |
| D.未等温度升到最高值就记录温度计示数 |
用下图所示装置进行中和热测定实验,请回答下列问题:

(1)大小烧杯之间填满碎泡沫塑料的作用是________,从实验装置上看,图中缺少的一种玻璃仪器是________.
(2)使用补全仪器后的装置进行实验,取50 mL 0.25 mol/L H2SO4溶液与50 mL 0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃.已知中和后生成的溶液的比热容c为4.18J/(g·℃),溶液的密度均为1g/cm3.通过计算可得中和热ΔH=________,H2SO4与NaOH反应的热化学方程式________.
(3)实验中若用60 mL 0.25 mol·L-1 H2SO4溶液跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”、“不相等”),所求中和热________(填“相等”、“不相等”);若用50 mL 0.50 mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会________.
(填“偏大”、“偏小”、“不受影响”)
(4)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1________ΔH(填“<”、“>”或“=”),理由是________.
|
酸碱中和生成 1 mol H2O时所放出的热量称为中和热.含NaOH 20.0 g的稀溶液与足量稀盐酸反应,放出28.7 kJ的热量,表示该反应中和热的热化学方程式正确的是 | |
| [ ] | |
A. |
NaOH(aq)+HCl(aq) |
B. |
NaOH(aq)+HCl(aq) |
C. |
NaOH(aq)+HCl(aq) |
D. |
NaOH(aq)+HCl(aq) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com