
题目列表(包括答案和解析)
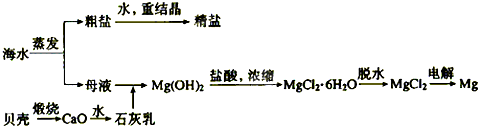
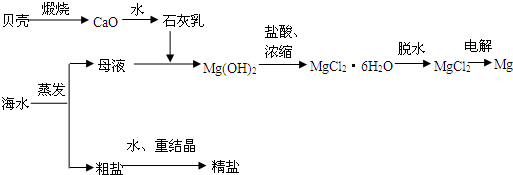
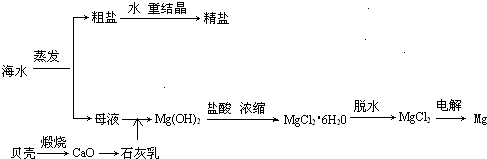
(04年广东卷)海水的综合利用可以制备金属镁,其流程如下图所示:
|
(1)若在空气中加热MgCl2?6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程
式。
用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2?6H2O时,能得到无水MgCl2,其原因是
。
(2)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
。
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到
玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
溶解时: 。
过滤时: 。
蒸发时: 。
| ||

| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com