
题目列表(包括答案和解析)
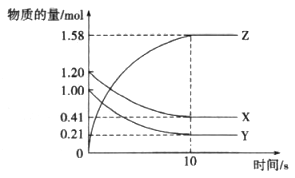
(8分)化学反应的快慢和限度对人类生产生活有重要的意义。
(1)请将影响表中“实例”反应速率的“条件”仿照示例填在空格横线上。
| 实例 | 影响条件 |
| ①食物放在冰箱里能延长保质期 | 温度(示例) |
| ②实验室将块状药品研细,再进行反应 | ____________ |
| ③用H2O2分解制O2时,加入MnO2 | ____________ |
| ④工业制硫酸催化氧化SO2制取SO3时,通入过量的空气 | ____________ |
化学反应在工农业生产中有着重要的应用。按要求回答下列问题:
(1)利用化学反应可以制备许多物质。
①实验室用铜制备NO的离子方程式为___________________。
②可用Al和Fe2O3制Fe,该反应的化学方程式为___________________。
③海水提溴过程中,向浓缩的海水中通入氯气,再用热空气吹出生成的溴,然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-。这两步反应的离子方程式分别为__________、___________。
(2)化学反应能为人类生产生活提供能源。
①由反应CH4
+2O2 CO2
+2H2O,可以设计出以NaOH溶液为电解质溶液的燃料电池,该电池工作时负极的电极反应式为:______________。
CO2
+2H2O,可以设计出以NaOH溶液为电解质溶液的燃料电池,该电池工作时负极的电极反应式为:______________。
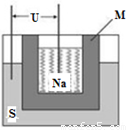
②2011年山东高考化学中曾提到钠硫高能电池,右图是该电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS=Na2Sx。该电池负极为________(填化学式),正极的电极反应式为 。用该电池作电源进行粗铜精炼时,当得到64g精铜时,理论上该电池负极消耗的质量为_____g。
化学反应在工农业生产中有着重要的应用。按要求回答下列问题:
(1)利用化学反应可以制备许多物质。
①实验室用铜制备NO的离子方程式为___________________。
②可用Al和Fe2O3制Fe,该反应的化学方程式为___________________。
③海水提溴过程中,向浓缩的海水中通入氯气,再用热空气吹出生成的溴,然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-。这两步反应的离子方程式分别为__________、___________。
(2)化学反应能为人类生产生活提供能源。
①由反应CH4 +2O2 CO2 +2H2O,可以设计出以NaOH溶液为电解质溶液的燃料电池,该电池工作时负极的电极反应式为:______________。
CO2 +2H2O,可以设计出以NaOH溶液为电解质溶液的燃料电池,该电池工作时负极的电极反应式为:______________。
②2011年山东高考化学中曾提到钠硫高能电池,右图是该电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS=Na2Sx。该电池负极为________(填化学式),正极的电极反应式为 。用该电池作电源进行粗铜精炼时,当得到64g精铜时,理论上该电池负极消耗的质量为_____g。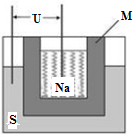
 化学反应可视为旧键断裂和新键形成的过程。已知断开1mol下列化学键时需要吸收的能量分别为:
化学反应可视为旧键断裂和新键形成的过程。已知断开1mol下列化学键时需要吸收的能量分别为:
P-P 198kJ、 P-O 360 kJ、 O=O 498 kJ
已知:白磷(P4)和P4O6的分子结构如图所示。
白磷燃烧生成P4O6
(1)白磷和P4O6中的化学键类型分别为 和
(2)1mol P4 燃烧生成P4O6时放出 kJ热量 。
化学反应原理:
(14分)近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知 ① 2 CH4 (g) + 3O2 (g) = 2 CO (g) + 4 H2O(l) △H1 = -1214.6 KJ/mol
② 2 CO (g) + O2(g) = 2 CO2 (g) ΔH2 = -566 kJ/mol
则反应CH4(g) + 2 O2 (g) = CO2 (g) + 2 H2O (l) 的△H = 。
(2)将两个石墨电极插人KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极,其电极反应式是:CH4 + 10 OH―― 8e-= CO32-+ 7 H2O;通入O2的一极,其电极反应式是 。
(3)若用石墨做电极电解500 ml饱和食盐水,写出电解反应的离子方程式为: ;电解一段时间后两极共收集到标准状况下的气体1.12 L(不考虑气体的溶解)。停止通电,假设反应前后溶液体积不变,则所得溶液的pH= 。
![]() (4)将不同量的CO (g) 和H2O (g) 分别通入到体积为2 L的恒容密闭容器中,进行反应
(4)将不同量的CO (g) 和H2O (g) 分别通入到体积为2 L的恒容密闭容器中,进行反应
CO (g) + H2O (g) CO2 (g) + H2 (g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
① 实验1中以υ(H2) 表示的反应速率为 。
② 实验2中的平衡常数是 (计算结果保留两位小数)。
③ 该反应的正反应为 (填“吸”或“放”)热反应。
④ 若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),
则a、b应满足的关系是 (用含a、b的数学式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com