
题目列表(包括答案和解析)
汞(Hg)、铬(Cr)是影响环境污染、生物效应和人类健康的重金属元素。
I、铬广泛应用于钢铁工业、磁带和录像带等方面。
(1)工业常采用“铝在高温条件下还原铬绿(Cr2O3)”制备铬单质,该反应的化学方程式为 。
II、含铬的工业废水会导致慢性中毒。处理含+6价铬的废水时可得到铁氧体(其组成可写作[Fe2+Fe3+(2-x) Cr3+x]O4)。

(2)加过量FeSO4的目的是 。
(3)配平步骤①的反应的离子方程式 Fe2++ Cr2O72—+ _____== Fe3++ Cr3++ H2O
并计算铁氧体( [Fe2+Fe3+(2-x) Cr3+x]O4)中X= _________________。
(4)下表是实验检测中心对某地区二个点的土壤样品(每个点分三层取样,共6个样品)进行了有机质和铬总量的测定,结果见下表。
|
样品序号 |
取样深度(m) |
有机质(×10—2g) |
总铬(×10—6g) |
|
样品A-1 |
0.00 ~ 0.30 |
2.81 |
114 |
|
样品A-2 |
0.30 ~ 0.60 |
1.72 |
111 |
|
样品A-3 |
1.20 ~ 1.80 |
1.00 |
88 |
|
样品B-1 |
0.00 ~ 0.30 |
2.60 |
116 |
|
样品B-2 |
0.30 ~ 0.60 |
2.48 |
112 |
|
样品B-3 |
1.20 ~ 1.80 |
1.83 |
106 |
从表中你可以得出的结论有 (答一点即可)。
(5)工业上以铬酸钾(K2CrO4)为原料,电化学法制备重铬酸钾,装置如图。反应为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+
2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+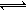 Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为
。原因是
。
Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为
。原因是
。
某短周期元素A,其最高价氧化物对应水化物甲与其气态氢化物乙反应可生成盐丙。已知乙的密度是同温同压下H?2密度的8.5倍。
请回答:
(1)乙的电子式为 。
(2)甲具有不稳定性,其发生分解的化学反应方程式为 。
实验室保存甲的方法是 。
(3)在一定条件下,将乙放入固定容积的密闭容器中使其发生分解反应,已知△H>0,达到平衡状态后,改变其中一个条件X,Y随X的变化符合图中曲线的是
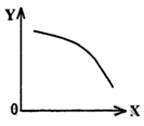 (选填字母)
(选填字母)
a.当X表示温度时,Y表示乙的物质的量
b.当X表示压强时,Y表示乙的转化率
c.当X表示反应时间时,Y表示混合气体的密度
d.当X表示乙的物质的量时,Y表示某一生成物的物质的量
(4)现有硫酸甲的混合液20mL,其中硫酸的物质的量浓度为2mol?L―1,甲的物质的量浓度为1mol?L-1。向该混合液中加入0.96g铜粉,假设只生成一种无色气体,则所收集到的气体的体积在标准状况下为 。
(5)丙对水的电离起 作用(填“抑制”、“促进”或“不影响”),原因是(结合离子方程式简要说明) 。
化学反应速率与化学平衡在日常生活、工农业生产和科学研究中具有重要的意义,在
化学实验中涉及的电离平衡也属于化学平衡。请回答下列问题:
(1)某研究性学习小组查阅资料发现金属氧化物A也能催化氯酸钾的分解,且A和二
氧化锰的最佳催化温度均为500℃左右。于是对A和二氧化锰的催化性能进行了
定量对照实验。实验时均以收满500 mL氧气为准(其他可能影响实验的因素均已
忽略)。
表一 用MnO2作催化剂
| 实验序号 | KClO3质量/g | MnO2质量/g | 反应温度/℃ | 待测数据 |
| 1 | 8.00 | 2.00 | 500 | |
| 2 | 8.00 | 2.00 | 500 |
表二 用A作催化剂
| 实验序号 | KClO3质量/g | A的质量/g | 反应温度/℃ | 待测数据 |
| 1 | 8.00 | 2.00 | 500 | |
| 2 | 8.00 | 2.00 | 500 |
请回答:上述实验中的待测数据应是 。
完成此研究后,他们准备发表一篇研究报告,请你替他们拟一研究报告的标题:
。
(2)氨水是一种弱碱,某同学取0.1mo/L的氨水,用pH试纸测其pH,结果发现溶液的
pH约为11,以此得出氨水为弱碱的结论。该同学用pH试纸测定氨水pH的具体操
作是 。
(3)证明氨水是弱碱的常用方法还有两种:一是设法证明NH![]() 的水解,一是设法使氨水
的水解,一是设法使氨水
电离平衡发生移动。
方法一:取少量NH4Cl晶体溶于水,滴入石蕊试液,溶液变红,可见溶液显酸性。
其原因是 。
方法二:取少量氨水,滴入酚酞变红后再加入 ,振荡,红色变浅,c(OH—)下降,说明氨水的电离平衡向 移动。
(12分)Na2CO3俗称纯碱、苏打,NaHCO3俗称小苏打,两者在日常生活和工业生产中都有着广泛的应用。某化学兴趣小组设计了如下实验来探究两者的某些性质。请你根据所学知识帮他们完成有关的设计和实验。
(1)甲同学测定两者的酸碱性:各取一定量的固体溶于水,配成相同浓度的溶液,测定其pH值,测定结果为Na2CO3、NaHCO3的pH分别为a和b(a、b均大于7)。
Ⅰ.测定溶液的pH值所用的主要仪器有:pH试纸、表面皿、 和标准比色卡。
Ⅱ.有关①100mL0.1 mol·L-1NaHCO3、②100mL0.1 mol·L-1Na2CO3两种溶液的叙述不正确的是( )
| A.溶液中水电离出的OH-个数:②>① | B.溶液中阴离子的物质的量浓度之和:②>① |
| C.①溶液中:c(CO32-)>c(H2CO3) | D.②溶液中:c(HCO3-)>c(H2CO3) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com