
题目列表(包括答案和解析)
Ⅰ.课本中通过向草酸(H2C2O4)溶液中滴加用硫酸酸化高锰酸钾中研究浓度对化学反应速率的影响,请你写出该反应的化学方程式 ,该反应不需使用指示剂的原因是 ;
Ⅱ.某同学根据课本外界条件对化学反应速率的影响原理,设计了硫代硫酸钠与硫酸反应有关实验,实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:
实验
序号 反应温度
(℃) 参加反应的物质
Na2S2O3 H2SO4 H2O
V/mL c/mol•L-1 V/mL c/mol•L-1 V/mL
A 20 10 0.1 10 0.1 0
B 20 5 0.1 10 0.1 5
C 20 10 0.1 5 0.1 5
D 40 5 0.1 10 0.1 5
(1)写出上述反应的离子方程式
(2)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是 (填实验序号)
(3)在利用比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有 关的各项反应条件.其中:
①能说明温度对该反应速率影响的组合比较是 ;(填实验序号)
②A和B、A和C的组合比较所研究的问题是
③B和C的组合比较所研究的问题是
(4)教材是利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小的可能原因:
| A | 2- 8 |
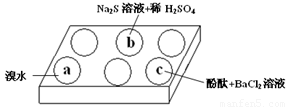
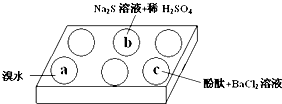 某化学小组进行Na2SO3 的性质实验探究.
某化学小组进行Na2SO3 的性质实验探究.| 编号 | 实验现象 |
| a | 溴水褪色 |
| b | 产生淡黄色沉淀 |
| c | 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
某化学小组进行Na2SO3 的性质实验探究。
(1)在白色点滴板的a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:
实验现象如下表:
|
编号 |
实验现象 |
|
a |
溴水褪色 |
|
b |
产生淡黄色沉淀 |
|
c |
滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
根据实验现象进行分析:
① a中实验现象证明Na2SO3具有 性。
② b中发生反应的离子方程式是 。
③ 应用化学平衡原理解释c中现象(用化学用语及简单文字表述) 。
(2)在用NaOH 溶液吸收SO2 的过程中,往往得到Na2SO3和NaHSO3 的混合溶液,溶液pH 随n(SO32-):n(HSO3-) 变化关系如下表:
|
n(SO3 2—): n(HSO3—) |
91:9 |
1:1 |
9:91 |
|
pH |
8.2 |
7.2 |
6.2 |
① 当吸收液中n(SO32-):n(HSO3-) =10:1 时,溶液中离子浓度关系正确的是 (填字母)。
A.c(Na+) +c(H+) = 2c(SO32-) +c(HSO3-) + c(OH-)
B.c(Na+) > c(HSO3-) > c(SO32-) > c(OH-)>c(H+)
C.c(Na+) > c(SO32-) > c(HSO3-) > c(OH-)>c(H+)
② 若n(SO32-):n(HSO3-) = 3:2,则0.8 mol NaOH溶液吸收了标准状况下的SO2 L。
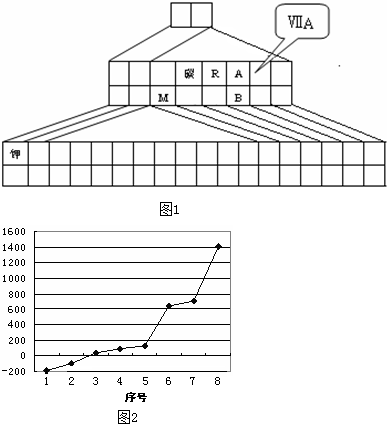
(13分)右图是元素周期表的另一种画法——三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置。回答下列问题:
⑴请在右图中将过渡元素所在的位置“用斜线”画出。
⑵R的第一电离能 A的第一电离能(填大于、小于或等于);写出铷元素原子的外围电子排布式 ;
⑶R的氢化物在A的氢化物中溶解度极大,原因是 ;
A的氢化物比B的氢化物热稳定性强,原因是 。
⑷图中A、B两元素形成的离子中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。该离子可能具有的化学性质是_________,依据是_______________________________。
⑸第三周期8种元素按单质熔点(℃)高低的顺序如右图,(已知序号“1”代表Ar),其中序号 “8”代表 (填元素符号);其中电负性最大的是 (填下图中的序号)。
⑹C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键的原因
_______________________________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com