
题目列表(包括答案和解析)
若室温时0.1mol•L-1的盐NaX溶液PH=9,则该溶液中起水解反应的X-离子占全部X离子的是
A.0.01% B.0.09% C.1.0% D.无法确定
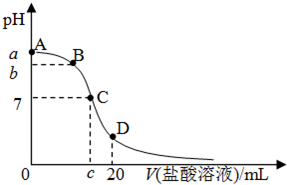 (2011?常州三模)25℃,在20mL 0.1mol/L 氨水溶液中逐滴加入0.2mol/LHCl溶液(如图),下列说法正确的是( )
(2011?常州三模)25℃,在20mL 0.1mol/L 氨水溶液中逐滴加入0.2mol/LHCl溶液(如图),下列说法正确的是( )| A、无法确定 | B、0.09% | C、1.0% | D、0.01% |
A.0.01% B.0.09%
C.1.0% D.无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com