
题目列表(包括答案和解析)
| |||||||||||||||||||||||||||
高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.
(1)已知:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2.K2FeO4在处理水的过程中所起的作用有________.
4Fe(OH)3+8OH-+3O2.K2FeO4在处理水的过程中所起的作用有________.
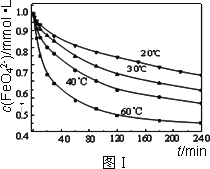
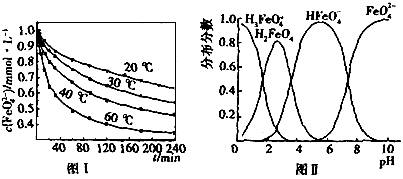
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ.该实验的目的是________;发生反应的ΔH________0(填“>”、“<”或“=”).
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示.下列说法正确的是________(填字母).
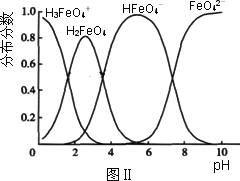
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-![]() FeO42-+H2O
FeO42-+H2O
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤3:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2溶液V1 mL.滴定时发生的反应为:Fe2++Cr2O72-+H+![]() Fe3++Cr3++H2O(未配平)
Fe3++Cr3++H2O(未配平)
①写出步骤2中发生反应的离子方程式________.
②根据上述实验数据,测定该溶液中K2FeO4的浓度为________mol·L-1(用含字母的代数式表示).
高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。其水溶液中FeO42-的存在形态如右图所示。下列说法正确的是

A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4-的分布分数先减小后增大
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O
D.H2FeO4的某些性质与H2O相似
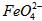 与水反应的化学方程式:
与水反应的化学方程式: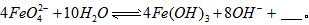
 在处理水的过程中所起的作用是____________和_____________。
在处理水的过程中所起的作用是____________和_____________。 配制成c(
配制成c(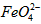 )=1.0mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(
)=1.0mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(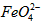 )的变化,结果见图I。第(1)题中的反应为
)的变化,结果见图I。第(1)题中的反应为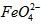 的变化的主反应,则温度对该反应的反应速率和平衡移动的影响是__________________;发生反应的△H_________0(填“﹥”、“﹤”或“=”)。
的变化的主反应,则温度对该反应的反应速率和平衡移动的影响是__________________;发生反应的△H_________0(填“﹥”、“﹤”或“=”)。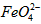 在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是________(填字母)。
在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是________(填字母)。 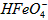 的分布分数先增大后减小
的分布分数先增大后减小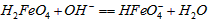
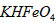 稀溶液加入水的过程中,pH可能增大也可能减小
稀溶液加入水的过程中,pH可能增大也可能减小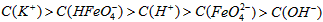
 Fe3+(aq)+3OH-(aq),已知25℃时,溶度积常数
Fe3+(aq)+3OH-(aq),已知25℃时,溶度积常数高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。其水溶液中FeO42-的存在形态如右图所示。下列说法正确的是

A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4-的分布分数先减小后增大
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O
D.H2FeO4的某些性质与H2O相似
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com