
题目列表(包括答案和解析)
 2NH3↑+2H2O+CaCl2] 。
2NH3↑+2H2O+CaCl2] 。 
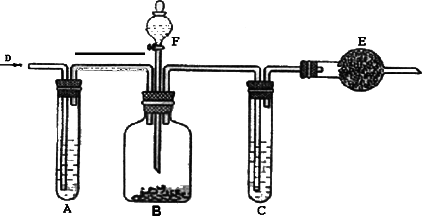
工业纯碱中常含有少量NaCl的杂质,可用下列装置测定纯碱中碳酸钠的质量分数.如图所示,D处鼓入空气,A试管盛有NaOH溶液,F是盛有稀硫酸的分液漏斗,B广口瓶中放的是含有NaCl的Na2CO3固体,C为盛有浓硫酸的试管,E为盛有碱石灰(NaOH和CaO的混合物)的干燥管.
实验操作如下:
①检查装置的气密性.
②在干燥管内填满颗粒状碱石灰,称总重为W1g.
③称取一定量纯碱W2g,并放在广口瓶内.
④缓缓地加入稀硫酸到不产生气体为止.
⑤缓缓鼓入空气约5分钟后,再称干燥管总重为W3g.
试回答下列问题:
(1)鼓入空气的目的和装置E的作用分别是什么?________;________.
(2)装置A的作用是_____________________.
(3)装置C的作用是_____________________.
(4)碳酸钠质量分数计算式为_____________.
(5)如撤去A则测定结果将________.(填“偏大”或“偏小”或“不影响”)
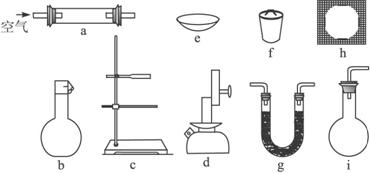
U形管中所装药品为①碱石灰(NaOH和CaO的固体混合物);②无水CaCl2
(1)为确定某固体有机物的最简式(实验式),上述仪器中需要的种类有______________种,它们是______________ (填仪器编号,下同),其中使用最多的是______________,为完成实验测定还缺少的一种重要仪器名称是______________。
(2)当g中盛碱石灰时装置的作用是______________;盛碱石灰的装置至少需要使用_________次;盛无水氯化钙的装置至少需要使用______________次。
(3)确定固体有机物是烃还是其含氧衍生物的依据是____________________________。
(4)为确定其分子式还需知道下述中的______________(填字母)。
A.熔、沸点 B.可换算成标准状况下蒸气的密度
C.固体有机物的体积 D.重要的化学性质

U形管中所装药品为①碱石灰(NaOH和CaO的固体混合物);②无水CaCl2
(1)为确定某固体有机物的最简式(实验式),上述仪器中需要的种类有_____________种,它们是_____________(填仪器编号,下同),其中使用最多的是_____________,为完成实验测定还缺少的一种重要仪器名称是__________________________。
(2)当g中盛碱石灰时装置的作用是_____________;盛碱石灰的装置至少需要使用_______次;盛无水氯化钙的装置至少需要使用_______次。
(3)确定固体有机物是烃还是其含氧衍生物的依据是_____________。
(4)为确定其分子式还需知道下述中的_____________(填字母)。
A.熔、沸点 B.可换算成标准状况下蒸气的密度
C.固体有机物的体积 D.重要的化学性质
沼气(主要成分是甲烷)是一种廉价的能源,把农村中大量存在的农作物秸秆、杂草、人畜粪便等在沼气池中发酵,便可产生沼气,沼气完全燃烧可以用来点灯、做饭.
(1)在101 kPa时,32 g CH4燃烧生成CO2和气态H2O,放出1604 kJ的热量,写出甲烷燃烧的热化学方程式为________.
(2)120℃,取CH4和过量O2的混合气体共0.4 mol,点燃使其充分反应,将燃烧后的气体通过足量的碱石灰(NaOH和CaO的固体混合物)充分吸收,碱石灰增重8 g.
计算:①原混合气体中CH4和O2的体积比是多少?
②反应放出多少热量?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com