
题目列表(包括答案和解析)
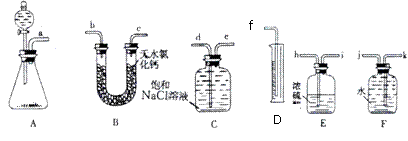
(08泉州五中模拟)已知漂白粉的有效成分能与浓盐酸反应生成Cl2和一种固体时能作干燥剂的物质等。请从下图中选用适当的实验装置,设计一个最简单的实验,测定漂白粉有效成分的质量分数。
 |
请填写下列空白:
(1)实验中漂白粉有效成分与浓盐酸反应的化学方程式为 。
(2)所选用装置的连接顺序应是(填各接口的字母代号) 。
(3)在读取量筒的刻度数时,应注意__________。
(4)若各仪器内仍残留有少量Cl2,则测定结果将(填“偏高”、“偏低”或“不影响” ) ,其原因是_______________-。
(5)某同学在实验中发现量筒里未收集到液体,其失败的原因可能是下列中的(填A、B、
C等代号) 。
①装置漏气 ②浓盐酸已变成稀盐酸 ③所选仪器容积太大
④漂白粉已全变质 ⑤e接f ⑥d接f
A.①②③ B.①②④⑤ C.①②④⑥ D.全部2009年春夏之交,北美的墨西哥等国爆发了“人感染甲型H1N1流感”疫情,疫情的病原体为“甲型H1N1流感”病毒,它可以在人与人之间传播.科学研究表明,经常使用消毒药物(如漂粉精等)对生活环境进行消毒,能有效控制其传染速度.已知工业上常将氯气通入冷的消石灰中充分反应制取漂白精.
(1)将漂粉精溶于适量水中,液体呈白色浊状物,静置沉降.取少许上层清液,滴加碳酸钠溶液后出现白色沉淀,发生反应的离子方程式为________.另取上层清液少许,先滴加适量________,再滴加________(填化学式)溶液,即可检验Cl-的存在,发生反应的离子方程式为________.再取原上层清液少许,加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,说明漂粉精溶液呈________性并具有________性.
(2)已知漂粉精与浓盐酸作用能够产生氯气:Ca(ClO)2+4HCl(浓)![]() 2Cl2↑+CaCl2+2H2O.在该反应中,每生成1 mol Cl2,转移的电子总数为________个,被氧化的HCl的物质的量为________.
2Cl2↑+CaCl2+2H2O.在该反应中,每生成1 mol Cl2,转移的电子总数为________个,被氧化的HCl的物质的量为________.
(1)将漂粉精溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反应的离子方程式为____________________。另取少许上层清液,先滴加适量的_________ (填化学式)酸化,再滴加_________(填化学式)溶液即可检验Cl-的存在,发生反应的离子方程式为____________________。再取少许上层清液,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,说明漂粉精溶液呈__________性并具有__________性。
(2)漂粉精同盐酸作用产生氯气:Ca(ClO)2+4HCl====2Cl2↑+CaCl2+2H2O
该反应中,每生成1 mol Cl2,转移电子物质的量为__________,被氧化的HCl的物质的量为__________。
有效氯是漂粉精中有效成分Ca(ClO)2的含量大小标志,已知:有效氯
=![]() ×100%
×100%
若某漂粉精的有效氯为65%,则该漂粉精中Ca(ClO)2的质量分数=___________。
(计算结果保留小数点后1位。已知相对分子质量用Mr表示:Mr(Cl2)=71,Mr[Ca(ClO)2]=143)
(3)现用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂粉精,甲、乙、丙三人分别设计三个实验装置,如图1-3-1所示。已知Cl2与Ca(OH)2制漂粉精的反应是放热反应,而在较高温度下即发生如下反应:
6Cl2+6Ca(OH)2====5CaCl2+Ca(ClO3)2+6H2O
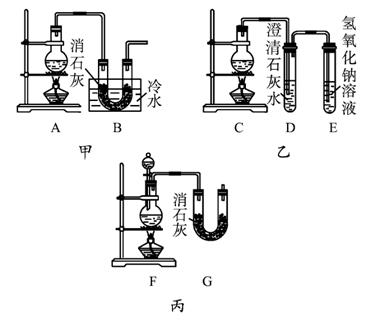
图1-3-1
①请指出三个装置各自的缺点或错误(如没有可不填):
甲____________________________________________________________,
乙____________________________________________________________,
丙____________________________________________________________。
②图中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左到右的方向)组装一套较完善的实验装置__________ (填所选部分的编号)。
③实验中若用100 mL 12 mol·L-1的浓盐酸与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总小于0.15 mol,其可能的主要原因是____________________ (假定各步反应均无反应损耗且无副反应发生)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com