
题目列表(包括答案和解析)
已知酸式盐NaHB在水溶液中存在下列反应:①NaHB==Na++HB-②HB- H++B2-③HB-+H2O
H++B2-③HB-+H2O H2B十OH-,且溶液中c(H+)>c(OH-),下列说法中一定正确的是
H2B十OH-,且溶液中c(H+)>c(OH-),下列说法中一定正确的是
| A.NaHB为强电解质 | B.H2B为强酸 |
| C.H2B为弱电解质 | D.HB-的电离程度小于HB-的水解程度 |
已知酸式盐NaHB在水溶液中存在下列反应:①NaHB==Na++HB-②HB-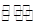 H++B2-③HB-+H2O
H++B2-③HB-+H2O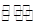 H2B十OH-,且溶液中c(H+)>c(OH-),下列说法中一定正确的是
H2B十OH-,且溶液中c(H+)>c(OH-),下列说法中一定正确的是
A、NaHB为强电解质 B、H2B为强酸
C、H2B为弱电解质 D、HB-的电离程度小于HB-的水解程度
已知酸式盐NaHB在水溶液中存在下列反应:①NaHB===Na++HB-,②HB-===H++B2-,③HB-+H2O===H2B+OH-,且溶液中c(H+)>c(OH-),则下列说法一定正确的是( )
A.NaHB为强电解质
B.H2B为强酸
C.NaHB溶液中仅存在HB-、B2-两种含B元素的离子
D.HB-的电离程度小于HB-的水解程度
已知酸式盐NaHB在水溶液中存在下列反应:①NaHB===Na++HB-,②HB-===H++B2-,③HB-+H2O===H2B+OH-,且溶液中c(H+)>c(OH-),则下列说法一定正确的是( )
A.NaHB为强电解质
B.H2B为强酸
C.NaHB溶液中仅存在HB-、B2-两种含B元素的离子
D.HB-的电离程度小于HB-的水解程度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com