
题目列表(包括答案和解析)
| A.向某FeCl3溶液中加入KSCN溶液,观察到溶液呈血红色,说明该FeCl3溶液中不含Fe2+离子 |
| B.先用水将pH试纸湿润,再测量某未知溶液的pH,若pH=1,说明该溶液中c(H+)=0.1mol?L-1 |
| C.在0.1mol?L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热后红色加深,说明盐类水解反应是吸热反应 |
| D.等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB |
 2PbSO4(s) +2H2O(l)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________(填写序号)。
2PbSO4(s) +2H2O(l)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________(填写序号)。 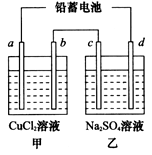
 H++A2-。
H++A2-。  CH3OH(g) △H=-90.8kJ/mol
CH3OH(g) △H=-90.8kJ/mol  CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol  CO2(g)+H2(g) △H=-41.3kJ/mol
CO2(g)+H2(g) △H=-41.3kJ/mol  2SO3(g)。在一定温度下,将0.23molSO2和0.11molO2通入容积为1L的密闭容器中发生反应,达到平衡后得到0.12molSO3,则反应的平衡常数K=__________。若温度不变,再通入0.50molO2后重新达到平衡,则SO3的体积分数将__________(填“增大”“不变”或“减小”)。
2SO3(g)。在一定温度下,将0.23molSO2和0.11molO2通入容积为1L的密闭容器中发生反应,达到平衡后得到0.12molSO3,则反应的平衡常数K=__________。若温度不变,再通入0.50molO2后重新达到平衡,则SO3的体积分数将__________(填“增大”“不变”或“减小”)。 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com