
题目列表(包括答案和解析)
(8分)【化学—化学与技术】
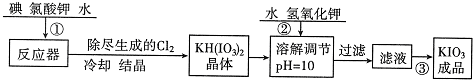
碘酸钾是一种白色结晶,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘;在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560 ℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:6I2 +11KClO3 +3H2O=6KH(IO3)2 + 5KCl + 3Cl2
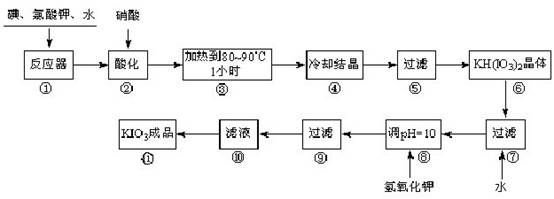
试回答下列问题:
(1)步骤①反应器发生的反应中,转移电子总数为___________;
(2)步骤②中,用硝酸而不用HI,其原因可能是______________________;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为________;
(4)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为:________;
(8分)【化学—化学与技术】
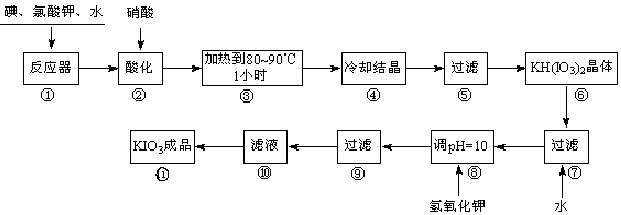
碘酸钾是一种白色结晶,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘;在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560 ℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:6I2 +11KClO3 +3H2O=6KH(IO3)2 +5KCl + 3Cl2
试回答下列问题:
(1)步骤①反应器发生的反应中,转移电子总数为___________;
(2)步骤②中,用硝酸而不用HI,其原因可能是______________________;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为________;
(4)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为:________;
| ||
| H2O2,H+ |
| 70℃ |
| K2CO3 |
| 滴定次数 | 盛标准Na2S2O4溶液的读数 | |
| 滴定前刻度(/mL) | 滴定后刻度(/mL) | |
| 1 | 1.02 | 11.03 |
| 2 | 2.00 | 11.99 |
| 3 | 0.20 | 10.20 |
| 1270 |
| 3w |
| 1270 |
| 3w |
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100gH2O | 8.08 | 12.6 | 18.3 | 24.8 |
| 1270 |
| 3w |
| 423.33 |
| w |
| 1270 |
| 3w |
| 423.33 |
| w |
| 实验步骤 | 实验操作 | 实验现象 |
| 步骤1 | 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 步骤2 | 滴入5滴淀粉溶液和1mL0.1 mol?L-1KI溶液,振荡. | 溶液无变化 |
| 步骤3 | 然后再滴入1滴1 mol?L-1的H2SO4,振荡. | 溶液变蓝色 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com