
题目列表(包括答案和解析)
①取5—6只集气瓶,用量筒装水分别测定它们的容积并标记;
②向集气瓶中分别装入其总容积的10%、20%、30%、40%、50%的水,并用毛玻璃盖住,依次编号为1、2、3、4、5;
③向大试管中加入1∶10(质量比)的MnO2和KClO3的混合物,加热使其反应,分别用排水集气法将上述1—5号瓶中的水排去;
④将带火星的木条依次插入1—5号瓶中,观察并记录现象,填入下表。
集气瓶编号 | 1 | 2 | 3 | 4 | 5 |
木条火星的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 |
请完成下列问题:
(1)用排水集气法收集到氧气后,2号瓶中氧气的体积分数约为___________。
(2)如果要得到更精确的数据,下一步实验研究时应向第6只集气瓶中加入其总容积的___________%(取整数值)的水后,再用排水法收集氧气,然后用带火星的木条来试验。
 煤的干馏是煤气化的重要方法,是煤综合利用最“古老”的方法,也是最简单的方法,所谓煤的干馏是在隔绝空气和高温的条件下,煤可以发生分解,生成固态的焦炭、液态的煤焦油、气态的焦炉气.下面是某实验小组设计的煤干馏实验,装置如图所示.取约2~3g的煤粒,在研钵中研磨至粉末状态;用药匙将煤粉放入玻璃管中,在具支试管中加入2mL水,然后按照如图所示安装好装置;点燃酒精灯,对玻璃管均匀受热后再集中受热,注意观察具支试管中气泡产生的速度;待具支试管中气泡产生的速度均匀后,用明火靠近具支试管的支管口处,可以观察到产生的气体能够燃烧.
煤的干馏是煤气化的重要方法,是煤综合利用最“古老”的方法,也是最简单的方法,所谓煤的干馏是在隔绝空气和高温的条件下,煤可以发生分解,生成固态的焦炭、液态的煤焦油、气态的焦炉气.下面是某实验小组设计的煤干馏实验,装置如图所示.取约2~3g的煤粒,在研钵中研磨至粉末状态;用药匙将煤粉放入玻璃管中,在具支试管中加入2mL水,然后按照如图所示安装好装置;点燃酒精灯,对玻璃管均匀受热后再集中受热,注意观察具支试管中气泡产生的速度;待具支试管中气泡产生的速度均匀后,用明火靠近具支试管的支管口处,可以观察到产生的气体能够燃烧.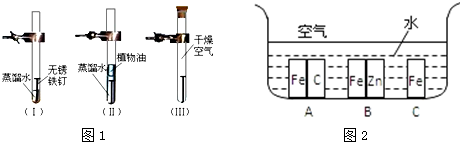
 (2011?朝阳区二模)某同学利用下面装置实现铜与浓、稀硝酸反应,过程如下:
(2011?朝阳区二模)某同学利用下面装置实现铜与浓、稀硝酸反应,过程如下:| 实验编号 | 水温/0C | 液面上升高度 | ||
| 1 | 25 | 超过试管
| ||
| 2 | 50 | 不足试管
| ||
| 3 | 0 | 液面上升超过实验1 |
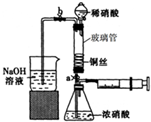 某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示:
某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示:| 实验编号 | 水温/℃ | 液面上升高度 | ||
| 1 | 25 | 超过试管的
| ||
| 2 | 50 | 不足试管的
| ||
| 3 | 0 | 液面上升超过实验1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com