
题目列表(包括答案和解析)
(12分)烟草制品燃烧时,所产生的烟雾中存在对人体健康有害的物质包括烟焦油、烟碱(如尼古丁)、CO、烟草生物碱、丙烯醛类、芳香胺、脂肪烯、酚类等一千多种有害物质。下图是检验点燃的香烟烟雾中有害成分的初步方法:
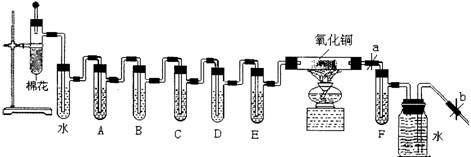
用于检验的试剂有:①乙醇,②澄清石灰水,③饱和NaOH溶液,④酸性高锰酸钾溶液,⑤浓硫酸,⑥银氨液,⑨氯化汞溶液,⑧氧化铜。
(1)将香烟燃烧后的产物进行吸收分析,使燃烧产物依次通过空气冷却、蒸馏水、乙醇……后面的药品顺序由你排定(用序号填入空格)A ,B ,C ,D ,E ,F (尼古丁和丙烯酸成分要单独取样分析)。
(2)要使香烟点燃后继续燃烧而不熄灭,怎样操作能得到保证 ;这是依据什么原理使香烟继续燃烧的?
(3)当更换第三支烟后,取出 中的略带黄色的样液5mL于试管中,后加入2mL银氨液放在水浴中加热,写出发生的银镜反应方程式 ;
(4)当燃尽第七支烟后,再取出 中的褐色样液5mL于试管,后向其中滴加数滴HgCl2溶液,产生白色溶液说明有尼古丁。
(5)通过观察硬质试管中的氧化铝颜色是否变化,来证明燃着的香烟产物中有无 CO?有人认为不行,他的理由是 。但是本实验还是能验证燃着的香烟产物中有CO产生的,是通过 装置中实验现象 得以证明。
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:

①检查气体发生装置A的气密性的操作是 。
②整套实验装置存在一处明显的不足,请指出: 。
(2)用改正后的装置进行实验,实验过程如下:
|
实验操作 |
实验现象 |
结论 |
|
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 |
D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:
|
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
|
ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2 。 ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点约5℃,与水发生水解反应。 ⅲ.AgClO、AgBrO均可溶于水。 |
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因:
,
请设计简单实验证明上述解释: 。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因: 。
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为 。
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验: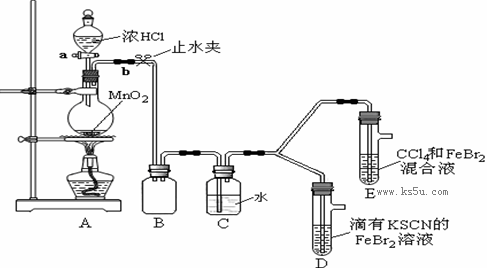
①检查气体发生装置A的气密性的操作是 。
②整套实验装置存在一处明显的不足,请指出: 。
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
| ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。 ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点约5℃,与水发生水解反应。 ⅲ.AgClO、AgBrO均可溶于水。 |
对实验过程中出现的异常现象进行探究,是实施素质教育、培养创新精神的有效途经。
【实验1】用下图实验装置进行铜与浓硫酸的反应,实验中发现试管内除了产生白色硫酸铜固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有黑色的CuO、CuS、Cu2S。查阅资料:CuS和Cu2S均为黑色固体,常温下都不溶于稀盐酸,在空气中煅烧,均转化为CuO和SO2。为了探究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:
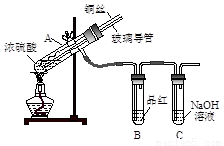
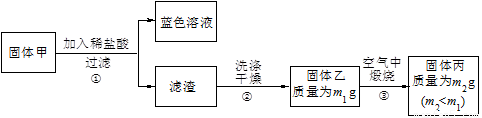
(1)上述实验装置除了有尾气吸收装置外,还有一个显著的优点是 。
(2)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有 。
(3)确定乙是否煅烧完全的操作是 。
(4)煅烧过程中一定发生的化学反应方程式为 。
【实验2】某化学兴趣小组设计了如下实验装置(尾气吸收装置未画出),探究Cl2、Br2、Fe3+的氧化性强弱。
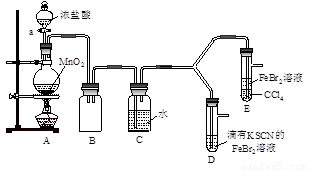
(5)根据下列实验操作和现象,填写实验结论。
|
实验操作 |
实验现象 |
结论 |
|
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 |
D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:
|
(6)因忙于观察和记录,没有及时停止反应,D、E中均发生了异常的变化:D装置中,红色慢慢褪去;E装置中,CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
|
ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2 。 ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应。 ⅲ.AgClO、AgBrO均可溶于水。 |
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因____ ;
请设计简单实验证明上述解释 。
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因 。
对实验过程中出现的异常现象进行探究,是实施素质教育、培养创新精神的有效途经。
【实验1】用下图实验装置进行铜与浓硫酸的反应,实验中发现试管内除了产生白色硫酸铜固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有黑色的CuO、CuS、Cu2S。查阅资料:CuS和Cu2S均为黑色固体,常温下都不溶于稀盐酸,在空气中煅烧,均转化为CuO和SO2。为了探究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验: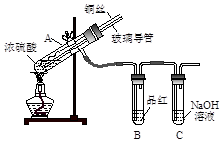

(1)上述实验装置除了有尾气吸收装置外,还有一个显著的优点是 。
(2)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有 。
(3)确定乙是否煅烧完全的操作是 。
(4)煅烧过程中一定发生的化学反应方程式为 。
【实验2】某化学兴趣小组设计了如下实验装置(尾气吸收装置未画出),探究Cl2、Br2、Fe3+的氧化性强弱。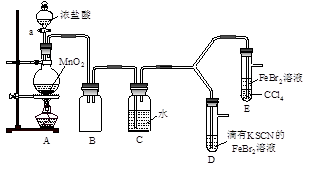
(5)根据下列实验操作和现象,填写实验结论。
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
| ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。 ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应。 ⅲ.AgClO、AgBrO均可溶于水。 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com