
题目列表(包括答案和解析)
通过核磁共振氢谱可以推知(CH3)3CCH2CH2OH中有多少种化学环境的氢原子
A、6 B、5 C、4 D、3
通过核磁共振氢谱可以推知(CH3)3CCH2CH2OH中有多少种化学环境的氢原子
A、6 B、5 C、4 D、3
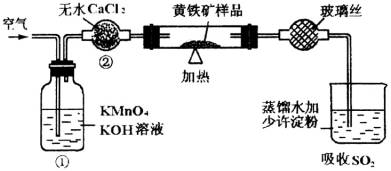
上图是一个实验室测定黄铁矿中硫的质量分数的装置。实验时有如下操作:
A.将试管中样品加热到800℃~850℃。
B.称取研细的黄铁矿样品
C.连接全部仪器,使其成为整套实验装置,并检查气密性。
D.将样品小心放入容器中。再将容器小心地推人试管中部。
E.以每分钟1L的速度鼓人空气。
F.用标准碘液滴定含淀粉的SO2水溶液。
(1)正确的实验步骤,其操作编号是
(2)装置①的作用是 ;装置②的作用是
(3)应根据 现象判断滴定已达到终点而停止鼓人空气。
(4)碘液跟二氧化硫水溶液发生反应的化学方程式是 。
A.0.1 B.0.4 C.0.2 D.0.3
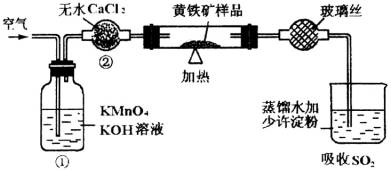
上图是一个实验室测定黄铁矿中硫的质量分数的装置。实验时有如下操作:
A.将试管中样品加热到800℃~850℃。
B.称取研细的黄铁矿样品
C.连接全部仪器,使其成为整套实验装置,并检查气密性。
D.将样品小心放入容器中。再将容器小心地推人试管中部。
E.以每分钟1L的速度鼓人空气。
F.用标准碘液滴定含淀粉的SO2水溶液。
(1)正确的实验步骤,其操作编号是
(2)装置①的作用是 ;装置②的作用是
(3)应根据 现象判断滴定已达到终点而停止鼓人空气。
(4)碘液跟二氧化硫水溶液发生反应的化学方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com