
题目列表(包括答案和解析)
 利用如图所示装置制取Fe(OH)2,通电后溶液中产生的白色沉淀能保持较长时间不变色.下列说法错误的是
利用如图所示装置制取Fe(OH)2,通电后溶液中产生的白色沉淀能保持较长时间不变色.下列说法错误的是 利用如图所示装置制取Fe(OH)2,通电后溶液中产生的白色沉淀能保持较长时间不变色.下列说法错误的是( )
利用如图所示装置制取Fe(OH)2,通电后溶液中产生的白色沉淀能保持较长时间不变色.下列说法错误的是( )(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图甲所示。


①X的化学式为__________,属于________(填“极性”或“非极性”)分子。
 ②图甲中条件选定的主要原因是(选填字母序号,下同)________。
②图甲中条件选定的主要原因是(选填字母序号,下同)________。
A.温度、压强对化学平衡的影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
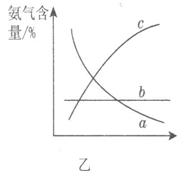
③改变反应条件,会使平衡发生移动。图乙表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是________,当横坐标为温度时,变化趋势正确的是__________。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应:
___________________________________________________________________。
②氨水中水电离出的c(H+)___________10-7 mol/L(填“>”、“<”或“=”)。
③将氨水和盐酸混合后,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
Ⅰ、若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
Ⅱ、若上述关系中C是正确的,则溶液中溶质的化学式是 。
Ⅲ、若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl) c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+) c(Cl-)。
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成X和Y两种物质。X为铵盐,Y在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96 L氨气(标准状况),同时生成0.3 mol X。
①写出氨气和氟气反应的化学方程式: ___________________________________。
②在标准状况下,每生成1 mol Y,转移电子的物质的量为___________mol。
(4)已知液态NH3与H2O相似,也可以发生微弱的电离,电离出含有相同电子数的微粒,则液态NH3的电离方程式为:
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图甲所示。
①X的化学式为__________,属于________(填“极性”或“非极性”)分子。
②图甲中条件选定的主要原因是(选填字母序号,下同)________。
A.温度、压强对化学平衡的影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动。图乙表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是________,当横坐标为温度时,变化趋势正确的是__________。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应:
___________________________________________________________________。
②氨水中水电离出的c(H+)___________10-7 mol/L(填“>”、“<”或“=”)。
③将氨水和盐酸混合后,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
Ⅰ、若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
Ⅱ、若上述关系中C是正确的,则溶液中溶质的化学式是 。
Ⅲ、若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl) c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+) c(Cl-)。
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成X和Y两种物质。X为铵盐,Y在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96 L氨气(标准状况),同时生成0.3 mol X。
①写出氨气和氟气反应的化学方程式: ___________________________________。
②在标准状况下,每生成1 mol Y,转移电子的物质的量为___________mol。
(4)已知液态NH3与H2O相似,也可以发生微弱的电离,电离出含有相同电子数的微粒,则液态NH3的电离方程式为:
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图甲所示。
①X的化学式为__________,属于________(填“极性”或“非极性”)分子。 ②图甲中条件选定的主要原因是(选填字母序号,下同)________。
②图甲中条件选定的主要原因是(选填字母序号,下同)________。
A.温度、压强对化学平衡的影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动。图乙表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是________,当横坐标为温度时,变化趋势正确的是__________。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应:
___________________________________________________________________。
②氨水中水电离出的c(H+)___________10-7 mol/L(填“>”、“<”或“=”)。
③将氨水和盐酸混合后, 某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
Ⅰ、若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
Ⅱ、若上述关系中C是正确的,则溶液中溶质的化学式是 。
Ⅲ、若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl) c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+) c(Cl-)。
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成X和Y两种物质。X为铵盐,Y在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96 L氨气(标准状况),同时生成0.3 mol X。
①写出氨气和氟气反应的化学方程式: ___________________________________。
②在标准状况下,每生成1 mol Y,转移电子的物质的量为___________mol。
(4)已知液态NH3与H2O相似,也可以发生微弱的电离,电离出含有相同电子数的微粒,则液态NH3的电离方程式为:
必考卷
第Ⅰ卷共18小题,每小题6分,共108分。
一、选择题:选对的给6分,选错的得0分。
1.B 2.B 3.C 4.B 5.A
6.B 7.D 8.A 9.C 10.D 11.C 12.A
二、选择题:全部选对的给6分,选对但不全的给3分,有选错的得0分。
13.D 14.B 15.B C 16. A 17.AD 18.D
.files/image102.gif) 第Ⅱ卷共9题,共161分。
第Ⅱ卷共9题,共161分。
19.(18分)
(1)13.85 (5分)
.files/image103.gif) (2)① (4分)
(2)① (4分)
测量电路如图所示 (5分)
② 建议一:多测几组R、U数据,分别列方
程组求出E、r,再求出E、r平均值。
建议二:多测几组R、U数据,分别求出
相应的Ⅰ值,用U、Ⅰ数据作出U―Ⅰ图
线,由图线的截距、斜率求出E、r。
其他建议合理的同样给分。 (4分)
因电表选错导致①不能得分的,第②题可参照评分标准酌情给分。
20.(15分)
运动员从开始滑下至c点,由机械能守恒定律得
.files/image105.gif) ①
(5分)
①
(5分)
运动员滑至最低点时,由牛顿运动定律和向心力公式得
.files/image107.gif) ② (5分)
② (5分)
由①②得 .files/image109.gif) ③
③
代入已知数据,求得 .files/image111.gif) ④ (5分)
④ (5分)
21.(19分)
21.(1)设硬橡胶块与塑料盖恰好分离时,两者的共同速度为.files/image113.gif) ,从开始滑动到分离经历时间为t,在此期间硬橡胶块与塑料盖的加速度大小分别为a1、a2 ,由牛顿第二定律得:
,从开始滑动到分离经历时间为t,在此期间硬橡胶块与塑料盖的加速度大小分别为a1、a2 ,由牛顿第二定律得:
.files/image115.gif) ① (2分)
① (2分)
.files/image117.gif) ②
(2分)
②
(2分)
.files/image119.gif) ③ (2分)由以上各式得
③ (2分)由以上各式得
.files/image121.gif) ④ (2分)
④ (2分)
(2)设硬橡胶块与塑料盖恰好分离时,硬橡胶块移动的位移为.files/image123.gif) ,取硬橡胶块分析,应用动能定理得
,取硬橡胶块分析,应用动能定理得 .files/image125.gif) ⑤(3分)
⑤(3分)
由系统能量关系可得 .files/image127.gif) ⑥(3分)
⑥(3分)
由④⑤⑥式可得
.files/image129.gif) ⑦(3分)
⑦(3分)
因 .files/image131.gif) ,故硬橡胶块将落入污水井内 (2分)
,故硬橡胶块将落入污水井内 (2分)
.files/image132.gif) 22.(20分)
22.(20分)
(1)带电粒子从A点射入磁场区域后,由牛顿运
动定律和向心力公式得
.files/image134.gif) ① (2分)
① (2分)
∴ .files/image136.gif) ② (2分)
② (2分)
.files/image137.gif) (2)粒子运动轨迹如图1所示。 (6分)
(2)粒子运动轨迹如图1所示。 (6分)
(3)由①式得带电粒子运动速率 .files/image139.gif) ,即v与r成正比。
,即v与r成正比。
由题意可知,该粒子从A点射入磁场区域又不离开磁场外边界的最小可能轨道半径(如图2)
.files/image141.gif) ③ (4分)
③ (4分)
由此可得粒子从A点射入磁场区域又不离开磁场
外边界的允许的最大速率
.files/image143.gif) ④ (2分)
④ (2分)
∴ .files/image145.gif) ⑤ (2分)
⑤ (2分)
代入数据解得 .files/image147.gif) ⑥ (2分)
⑥ (2分)
23.(15分)
[探究一]
(1) 2NaA1O2+3H2↑ (3分)
(或 2Na[A1(OH)4]+3H2↑)
(2)偏高 (2分)
[探究二]
(1)不需要 (2分)
(2)检查装置的气密性(或合金完全溶解,或加入足量盐酸,或调整
量气管C的高度,使C中液面与B液面相平等合理答案) (3分)
[探究三]
(1)灼烧后固体的质量 (3分)
(2)是 (2分)
24.(15分)
(1)淀粉(或糖类、葡萄糖、油脂等合理答案) (1分)
(2)CH4 (1分)
O2 + 2H2O + 4e- = 4OH- (3分)
(3)该盐是硝酸铵,发生水解反应:NH4++H2O.files/image149.jpg) NH3•H2O
+H+,
NH3•H2O
+H+,
溶液呈酸性 (3分)
c(NO3-)> c(NH4+) > c(H+) > c(OH-) (3分)
(4)HCO3- + H+ H2O + CO2↑
(3分)
氨基乙酸(或甘氨酸) (1分)
25.(15分)
(1)SO3 +
H2O H2SO4
(3分)
(2)①< ②C (各3分,共6分)
(3)B (3分)
(4)根据SO2 ~ CaSO4•2H2O
.files/image151.jpg) (3分)
(3分)
26.(25分)
Ⅰ.
(1)①适量(一定浓度的)KOH溶液 (2分)
②(一定浓度的)葡萄糖溶液、微生物悬浮液各1mL (2分)
③测定细胞呼吸CO2释放量与O2消耗量的差值 (2分)
(2)④只进行有氧呼吸(进行有氧呼吸和产生乳酸的无氧呼吸) (2分)
⑤只进行产生酒精和CO2的无气氧呼吸 (2分)
⑥进行有氧呼吸和产生酒精、CO2的无氧呼吸 (2分)
(3)(任答一项,或其它合理答案) (3分)
①测定小麦种子的呼吸速率
②测定玉米幼苗的光合作用强度
③探究小麦幼苗、玉米幼苗光合作用强度的差异
Ⅱ.
(1)① ③ (各2分,共4分)
(2)④、⑤ (2分)
下丘脑分泌促甲状腺释放激素(TRH)和垂体分泌促
甲状腺激素(TSH) (2分)
(3)亢进 (2分)
27.(15分)
(1)存在生殖隔离 (3分)
(2)性状分离(高酚性状的植株);非同源 (各3分,共6分)
(3)用甲与乙杂交,得到F1;F1自交,获得F2,从中选出抗黄萎病、
抗虫植株继续自交,期望下代获得抗黄萎病、抗虫纯合体 (6分)
或:
|