
题目列表(包括答案和解析)
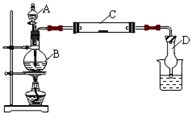 (2011?松江区模拟)为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中.试回答:
(2011?松江区模拟)为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中.试回答:
| ||
| ||
某校化学实验兴趣小组进行实验室制取氯气,并验证氯气的某些化学性质实验,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
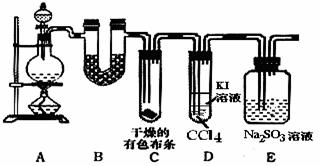
(1)下列方法中,可制得氯气的正确组合是 。
① MnO2和浓盐酸混合共热;② NaCl固体和浓硫酸混合共热;
③ 次氯酸钠和稀盐酸混合; ④ K2Cr2O7和浓盐酸混合;
⑤ KClO3和浓盐酸混合; ⑥ KMnO4和浓盐酸混合。
A.①②⑥ B.②④⑥ C.①③⑥ D.①④⑤⑥
(2)制取氯气时在烧瓶中加入一定量的MnO2,通过 (填仪器名称)向烧瓶中加入适量的浓盐酸,该反应的离子方程式: ;实验时为了除去氯气中的氯化氢气体,最好在A、B之间安装盛有 试剂的净化装置。
(3) 若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得Cl2的体积(标准状况下)
总是小于1.12 L的原因是
(4)①装置B中盛有 试剂(填序号)a.浓硫酸 b.碱石灰 c.五氧化二磷 d.无水氯化钙。其作用是
②装置C中的现象是 ;D中下层液体的现象是
③装置E中发生反应的离子方程式为
(5)乙同学认为甲同学的实验有缺陷,提出在 位置后(填字母)增加一个装置,该装置中应放入 试剂,其作用是
方法一:________________________________________。
方法二:________________________________________。
方法三:________________________________________。
方法四:________________________________________。
若制得相同质量的氧气,上述各反应中电子转移数目之比依次比为______________。
(20分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题: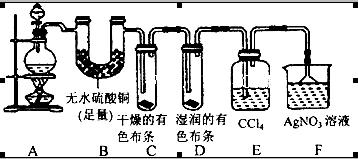
(1)下列方法中,可制得的正确组合是__________。
①MnO2和浓盐酸混合共热; ②MnO2、NaCl和浓硫酸混合共热:
③NaClO和浓盐酸混合; ④K2Cr2O7和浓盐酸混合:
⑤KClO3和浓盐酸混合共热; ⑥KMnO4和浓盐酸混合。
A.①②⑥B.②④⑥C.①④⑥ D.全部可以
(2)写出实验室制取Cl2的离子方程式____________。
(3)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制得Cl2的体积(标况下)总是小于1.12L的原因是_________________________________________。
(4)①装置B的作用是__________________________________。
②装置C和D出现的不同现象说明的问题是________________________。
③装置E的作用是_____________________。
(5)乙同学认为甲同学的实验有缺陷,不能确像最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置__________与________之间(填装置字母序号)增加一个装置,增加装置里面的试剂可为____________。
A.湿润的淀粉KI试纸B.氢氧化钠溶液
C.湿润的红色布条 D.饱和的食盐水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com