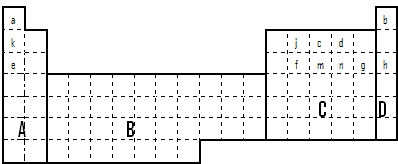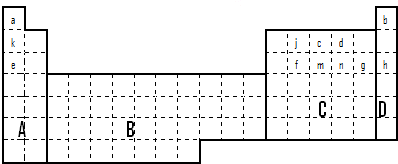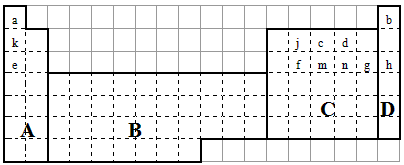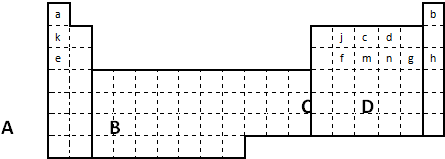
(1)在上面元素周期表中全部是金属元素的区域为______
(a)A (b)B (c)C (d)D
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或浓硝酸中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等.
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置.
②甲、乙两元素相比较,金属性较强的是______(填名称),可以验证该结论的实
验是______.
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
③写出甲的氧化物及氧化物对应水化物分别与强碱反应的离子方程式
______、______.
(3)表中所列小写字母分别代表一种化学元素:
①m、f、j的单质熔点由高到低的顺序______(填元素符号).
②以上元素形成的金属单质中,熔点最低的是______(填元素符号).
③f、m、n、g所形成的氢化物的稳定性还性由强到弱的顺序为______(填化学式);
④甲、乙、c、d、e形成的简单离子的半径由小到大的顺序为______.
⑤f元素单质是在生产中用量很大,试写出工业上制备f元素单质的化学方程式______.
⑥c元素的单质用途______(填一条).