
题目列表(包括答案和解析)
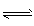 2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数(K)___________ ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常数(K)____________(填增大、减小、不变),其反应的正反应速率 ___________(填增大、减小、不变);温度升高_________(填有利或不利于)电池将化学能转化为电能。
2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数(K)___________ ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常数(K)____________(填增大、减小、不变),其反应的正反应速率 ___________(填增大、减小、不变);温度升高_________(填有利或不利于)电池将化学能转化为电能。 
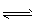 CO2(g)+H2(g)。 CO的转化率随时间变化关系如图,回答下列问题:
CO2(g)+H2(g)。 CO的转化率随时间变化关系如图,回答下列问题: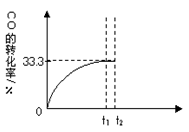
(1)将含有等物质的量的NaHSO4和Ba(OH)2溶液混合:Ba2+ +2OH-+2H++SO42-==BaSO4↓+ 2 H2O
(2)向碳酸氢钠溶液中加入过量澄清石灰水:Ca2++2OH-+2 HCO3-==CaCO3↓+2 H2O+ CO32-
(3)用0.2 mol · L-1的H2S溶液100 mL与0.1 mol · L-1 NaOH溶液300 mL 反应:H2S+2OH-= S2-+2H2O
(1) ;
(2) ;
(3) 。
| |||||||||||||||||||||||
(1)将含有等物质的量的NaHSO4和Ba(OH)2溶液混合:Ba2+ +2OH-+2H++SO![]() ==BaSO4↓+
2 H2O
==BaSO4↓+
2 H2O
(2)向碳酸氢钠溶液中加入过量澄清石灰水:Ca2++2OH-+2 HCO![]() ==CaCO3↓+2
H2O+ CO
==CaCO3↓+2
H2O+ CO![]()
(3)用0.2 mol · L-1的H2S溶液100 mL与0.1 mol · L-1 NaOH溶液300 mL 反应:H2S+2OH-= S2-+2H2O
(1) ;
(2) ;
(3) 。
(改编题)(8分) CH3OH(g)+H2O(g) CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
(1)在其它条件不变的情况下降低温度,则逆反应速率 (填“增大”或“减小”或“不变”,下同);在其它条件不变的情况下加压,则正反应速率 。
(2)一定条件下,向体积为2L的密闭容器中充入1molCH3OH(g)和3molH2O(g),20s 后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为 。
(3)判断该可逆反应达到平衡状态的依据是(填序号) 。
A v正(CH3OH)=v正(CO2)
B 混合气体的密度不变
C 混合气体的平均相对分子质量不变
D CH3OH、H2O、CO2、H2的浓度都不再发生变化
(4)在一定条件下,当该反应处于化学平衡状态时,下列操作可使化学平衡向逆反应方 向移动的是 (填序号)。
A.升高温度 B.降低温度 C.增大压强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com