
题目列表(包括答案和解析)
(本题共15分)空气中CO2浓度的持续走高引起人们的高度重视。一些科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2。为此,他们设想了一系列“捕捉”和“封存” CO2的方法。
【小题1】方法Ⅰ:一些科学家利用太阳能加热的反应器“捕捉”空气中的CO2,如下图所示。
(1)步骤一中的CaO俗称 。
(2)步骤二中发生反应的化学方程式是 ,该反应 (填“是”或“不是”)步骤一中反应的逆反应。
【小题2】方法Ⅱ:另一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如右图所示。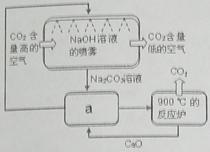
(1)NaOH溶液喷成雾状是为了 。
(2)右图a环节中,物质分离的基本操作是 。
(3)为了尽量减少成本,在整个流程中,循环利用的物质有CaO和 。
【小题3】下列溶液中,同样能用于“捕捉”二氧化碳的是( )。
| A.KNO3溶液 | B.CaCl2溶液 | C.CuSO4溶液 | D.Na2CO3溶液 |
| A.①③ | B.①② | C.②④ | D.③④ |
(15分,每小题各3分)下图中,A到L为常见物质或该物质的水溶液,B在A气体
中燃烧产生棕黄色烟,B、G为中学化学中常见金属单质,I的焰色反应为黄色,组成J的
元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品红溶液褪色。
|
(15分,每小题各3分)下图中,A到L为常见物质或该物质的水溶液,B在A气体
中燃烧产生棕黄色烟,B、G为中学化学中常见金属单质,I的焰色反应为黄色,组成J的
元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品红溶液褪色。
回答下列问题:
(1)J的结构式为 。
(2)K的电子式为 ,属于 晶体,所含的化学键有 。
(3)若D的水溶液呈黄色,沉淀H的化学式为 。
(4)若D的水溶液呈蓝色,B与C反应的化学方程式为 。
(5)G与H2O反应的离子方程式为 。
| |||||||||||||||||||||||||||||||||||||||||||||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com