
题目列表(包括答案和解析)
在有机化合物中,由于基团之间的相互影响,会使有机分子中相关原子或原子团的反应活性发生显著变化.
(1)同样以羟基(-OH)为官能团,乙醇为中性,苯酚却表现弱出酸性,请你另起一例,说明基团之间相互作用对物质化学性质的影响:
________________________________,
(2)实验表明,丙酸分子中“-CH2-”上的碳氢键因与“-COOH”相邻,反应活性明显增强.比如,在红磷存在时,丙酸可与液溴发生取代反应生成2-溴丙酸(CH3CHBrCOOH)请写出该反应的化学方程式________________________.
(3)已知含有“![]() ”结构的有机物不能稳定存在.请结合(1)、(2)有关信息,分析如下转化关系,回答问题:
”结构的有机物不能稳定存在.请结合(1)、(2)有关信息,分析如下转化关系,回答问题:
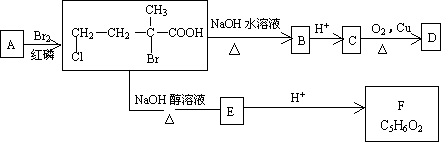
①A的结构简式为________.D中所含官能团的名称是________.
②C→D的化学方程式为________.
③D不可能发生的反应是________(填字母代号)
A.水解反应 b.消去反应 c.银镜反应 d.酯化反应 e.加成反应 f.还原反应 g.氧化反应
④F有多种同分异构体,其中含有![]() 两种官能团,且分子结构中只含一个甲基的有机物共有________种,写出其中一种的结构简式______________.
两种官能团,且分子结构中只含一个甲基的有机物共有________种,写出其中一种的结构简式______________.
| 实验 序号 |
反应温度 (℃) |
参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol?L-1 | V/mL | c/mol?L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
取3.40 g只含羟基,不含其他官能团的液态饱和多元醇,置于5.00 L氧气中,经点燃,醇完全燃烧。反应后气体体积减少0.56 L。将气体经足量NaOH溶液吸收,体积又减少2.80 L(所有体积均在标准状况下测定)。
(1)3.40 g醇中C、H、O物质的量分别为C_________mol,H_________mol,O_________mol,该醇中C、H、O的原子数之比为_________。
(2)由以上比值能否确定该醇的化学式?_________,其原因是______________________。
(3)如果将该多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有一种,试写出该饱和多元醇的结构简式:__________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com