
题目列表(包括答案和解析)
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度/g/100g水 | 18.5 | 20.8 | 26.3 | 32.8 | 40.1 | 48.4 | 52.4 | 50.9 | 43.7 |

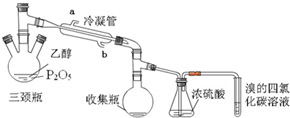 有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验.按表所示的量和反应条件在三颈瓶中加入一定量P2O5,并注入95%的乙醇,并加热,观察现象.
有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验.按表所示的量和反应条件在三颈瓶中加入一定量P2O5,并注入95%的乙醇,并加热,观察现象.| 实验 | P2O5/g | 95%乙醇量/mL | 加热方式 |
| 实验1 | 2 | 4 | 酒精灯 |
| 实验2 | 2 | 4 | 水浴70℃ |
| 实验 | 实验现象 | ||
| 三颈瓶 | 收集瓶 | 试管 | |
| 实验1 | 酒精加入时,立刻放出大量的白雾,开始有气泡产生,当用酒精灯加热时,气泡加快生成并沸腾,生成粘稠状液体. | 有无色液体 | 溶液褪色 |
| 实验2 | 酒精加入时,有少量白雾生成,当用水浴加热时,不产生气泡,反应一个小时,反应瓶内生成粘稠状液体 | 有无色液体 | 溶液不褪色 |
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
| ||
| ||
有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验。按右表所示的量和反应条件在三颈瓶中加入一定量P2O5,并注入95%的乙醇,并加热,观察现象。
|
实验 |
P2O5 |
95%乙醇量 |
加热方式 |
|
实验1 |
2g |
4mL |
酒精灯 |
|
实验2 |
2g |
4mL |
水浴70℃ |
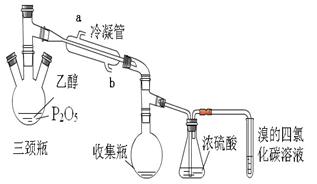
实验结果如下:
|
实验 |
实验现象 |
||
|
三颈瓶 |
收集瓶 |
试管 |
|
|
实验1 |
酒精加入时,立刻放出大量的白雾,开始有气泡产生,当用酒精灯加热时,气泡加快生成并沸腾,生成粘稠状液体。 |
有无色液体 |
溶液褪色 |
|
实验2 |
酒精加入时,有少量白雾生成,当用水浴加热时,不产生气泡,反应一个小时,反应瓶内生成粘稠状液体 |
有无色液体 |
溶液不褪色 |
根据上述资料,完成下列填空。
(1)写出乙醇制乙烯的化学方程式 。
(2)上图装置中冷凝管的作用是___________,进水口为(填“a”或“b”)______,浓硫酸的作用是 。
(3)实验1使溴的四氯化碳溶液褪色的物质是___________。
(4)实验2中,水浴加热所需仪器有 、 (加热、夹持仪器、石棉网除外)。
(5)三颈瓶、收集瓶中的液体经检验为磷酸三乙酯,写出三颈瓶中生成磷酸的化学方程式
_____________________,P2O5在实验1中的作用是______________________ 。
(6)根据实验1、2可以推断:
①以P2O5作为催化剂获得乙烯的反应条件是____________
②P2O5与95%乙醇在加热条件下可以发生的有机反应的类型是________反应。
氧化铜有多种用途,如用作玻璃着色剂,油类脱硫剂等,为获得纯净的氧化铜并探究其性质,某同学查找了溶度积数据并通过计算得到有关信息(见下表),用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
㈠制备氧化铜
![]()
⑴步骤Ⅰ的操作是加入水和少量硫酸溶解样品并过滤,目的是除去不溶性杂质,这一步骤中加酸的作用是 。
⑵步骤Ⅱ的操作是:滴加H2O2溶液,稍加热;待反应完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。
①这一步骤的目的是 ,
②写出加入H2O2溶液时发生反应的离子方程式
③控制溶液pH=3.5的目的是 ,
⑶步骤Ⅲ的目的是得到CuSO4·5H2O晶体,操作是 ,水浴加热烘干所得固体。水浴加热的特点是 。
㈡探究氧化铜性质
⑴取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡,结论是 。
⑵为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器或装置为 。(填写序号)
请回答下列问题:?
(1)铁屑表面少量的铁锈(主要成分为Fe2O3·aH2O)对制取硫酸亚铁有无影响 (填“有”或“无”)。其原因是: 。如有影响将如何操作? (若无影响,此问可以不答)。
(2)FeSO4在不同温度下的溶解度如下表所示:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度/g | 18.5 | 20.8 | 26.3 | 32.8 | 40.1 | 48.4 | 52.4 | 50.9 | 43.7 |
由于废铁屑含有C、Si等杂质,为了使FeSO4溶液的浓度增大,便于反应后分离溶液和残渣,该小组实验时采取了水浴加热和趁热过滤的方法。这样做的主要目的是为了防止 。你认为实验时的水浴温度最好控制在 ℃?左右。??
(3)测定晶体中结晶水含量所用的实验仪器除托盘天平(或物理天平)、研钵、坩埚、坩埚钳、三脚架、泥三角、酒精灯、药匙外,还有 ;判断晶体中结晶水完全失去的实验操作是 。?
(4)计算硫酸亚铁晶体化学式中x的实验值表达式为x= ?。(已知:硫酸亚铁晶体中结晶水的质量为m g、硫酸亚铁晶体的质量为w g)?
(5)由于铁屑或铁丝与硫酸反应速率慢,实验过程中有的同学提出采用电解的方法,可以加快制取FeSO4溶液的反应速率,该方法的电解质溶液是 ,阳极的电极反应方程式为: 。?
请你再写出一种(不包括改变温度和硫酸的浓度)以铁单质为反应物,能加快制取FeSO4溶液反应速率的方法: 。?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com