Ⅰ.在一定条件下,在一容积可变的密闭容器中,将SO
2和O
2混合发生反应:
2SO
2(g)+O
2(g)

2SO
3(g) ΔH=-92.3KJ/mol
反应过程中,SO
2、O
2、SO
3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为101KPa):
回答下列问题:
①________________时段,反应处于平衡状态。
②第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是__________,平衡________移动(填“正向”、“逆向”或“不移动”);n1=_______mol。
II. 在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是___________
A.c(HA)<c(A-)
B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-)
D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
回答下列问题:
①在同一溶液中,H
2CO
3、HCO
3-、 CO
32- (填:“能”或“不能”)_________ 大量共存。
②已知在25℃时,CO
32-水解反应的平衡常数(即水解常数用Kh表示)

当溶液中c(HCO
3-)︰c(CO
32-)=2︰1时,溶液的pH=_________________。
Ⅲ. 已知: H
2(g) + 1/2O
2(g) = H
2O(g) △H =-241.8KJ/mol
CO(g) + 1/2O
2(g) = CO
2(g) △H=-283.0KJ/mol
CH
4(g) + 2O
2 (g) = CO
2(g) + 2H
2O(g) △H =-802.3KJ/mol
甲烷与水蒸气反应生成水煤气的热化学方程式为______________________。

 2SO3(g) ΔH=-92.3KJ/mol
2SO3(g) ΔH=-92.3KJ/mol 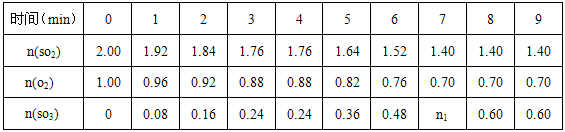


 2SO3(g) ΔH=-92.3KJ/mol
2SO3(g) ΔH=-92.3KJ/mol 

