
题目列表(包括答案和解析)
某课外活动小组拟用下列实验装置探究氯气与氨气之间的反应。其中A、B分别为氨气和氯气的发生装置;C为纯净、干燥的氯气与氨气反应的装置。表中的三个备选装置则是为完成实验必须的设备。各装置之间用橡胶管连接。请回答下列问题:

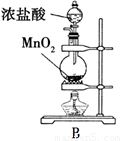
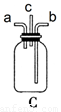
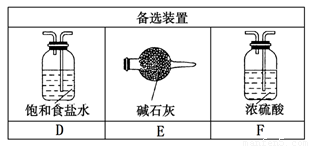
(1).若NH3从左向右流动,Cl2从右向左流动,则装置的正确连接顺序为:A、_____、_____、_____、_____、B(请将C、D、E、F填在相应的横线上)
(2)正确连接装置后,如何检验A装置的气密性____________________________________。
(3)装置A中的烧瓶内试剂可选用________(选填以下选项的代号)。
A.烧碱 B.浓硫酸 C.生石灰 D.五氧化二磷
(4)装置B中发生反应的离子方程式是______________________________________。
(5)反应开始后,C装置内产生白烟,试写出C内的化学反应方程式___________________。
(6)为使NH3与Cl2的混合更充分,Cl2应从C装置的______口进入(填“a”、“b”、“c”)
(7)该装置是否还存在着缺陷______(填“是”、“否”),如果有,其相应的改进措施是________________________________(如果没有,则不填该空)。
 (一)要配制浓度约为2mol/L NaOH溶液100mL,下面的操作正确的是
(一)要配制浓度约为2mol/L NaOH溶液100mL,下面的操作正确的是(17分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的 中,然后再用蒸馏水稀释到所需的浓度。若用惰性电极电解AgNO3的水溶液,请写出电池反应的离子方程式
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO32—水解所至。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1 m2(选填“<”、“=”、“>”)
(4)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:
负极:
正极: ;
②为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用________。
A.铜 B.钠 C.锌 D.石墨
③图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的________极。
(5)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
http://photo.blog.sina.com.cn/showpic.html- blog>
①氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b表示)。
②负极反应式为 。
③电极表面镀铂粉的原因为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com