
题目列表(包括答案和解析)
某溶液中含有两种溶质NaCl和H2SO4,其物质的量之比为3:1,用石墨做电极电解混合
溶液时,根据电极产物,可明显分为三个阶段,下列叙述不正确的是
A.阴极自始至终只析出H2 B.阳极自始至终只析出Cl2
C.电解最后阶段为电解水 D.溶液碱性不断增大
某溶液中含有两种溶质NaCl和H2SO4,其物质的量之比为3:1,用石墨做电极电解混合
溶液时,根据电极产物,可明显分为三个阶段,下列叙述不正确的是
A.阴极自始至终只析出H2 B.阳极自始至终只析出Cl2
C.电解最后阶段为电解水 D.溶液碱性不断增大
计算题(每题3分,共9分)(1)浓度不等的两种硫酸溶液等质量混合时,其质量分数为a%,而等体积混合时为b%;浓度不等的两种乙醇溶液等质量混合后,其质量分数为a%,而等体积混合时则为c%。则a、b、c由大到小排序为
(2)由钾和氧组成的某种离子晶体含钾的质量分数是78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为
(3) 有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)为 mol/L。
计算题(每题3分,共9分)(1)浓度不等的两种硫酸溶液等质量混合时,其质量分数为a%,而等体积混合时为b%;浓度不等的两种乙醇溶液等质量混合后,其质量分数为a%,而等体积混合时则为c%。则a、b、c由大到小排序为
(2)由钾和氧组成的某种离子晶体含钾的质量分数是78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为
(3) 有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)为 mol/L。
“水”电池是利用淡水与海水之间含盐量的差别进行发电的一种新型电池.
(1)研究表明,电池用二氧化锰纳米棒为正极材料可提高发电效率,这是利用纳米材料具有________特性,使之能与钠离子充分接触.
(2)“水”电池总反应可表示为:5MnO2+2Ag+2NaCl![]() Na2Mn5O10+2AgCl,该电池的负极反应式为________.
Na2Mn5O10+2AgCl,该电池的负极反应式为________.
(3)利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如下图所示,已知两电极的材料分别为石墨和铁.
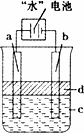
①若图中的电池为“水”电池,则其与a极相连的电极是由下列物质中的________制成(填编号,下同).
A.MnO2
B.Ag
C.NaCl
D.Na2Mn5O10
E.AgCl
②a极的电极反应式为________.
③电解液c可以是________.
A.纯水
B.NaCl溶液
C.H2SO4溶液
D.CuCl2溶液
④当生成1 mol Fe(OH)2白色沉淀时将消耗MnO2________mol.
(4)某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,溶液中金属阳离子的浓度与溶液pH的关系如下图.请据图分析:
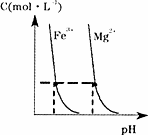
①该温度下,溶度积常数的关系为:KSP[Fe(OH)3]________KSP[Mg(OH)2](填“>”、“=”或“<”);
②如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com