(Ⅰ)氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)以天然气为原料制H
2是合成氨的一条重要的路线.甲烷的部分氧化,其反应式如下:
①CH
4(g)+1/2O
2 (g)=CO (g)+2H
2(g)△H
1=-35.6kJ?molˉ
1试判断常温下,上述反应能否自发进行______(填“能”或“否”),有研究认为甲烷部分氧化的机理为:
②CH
4(g)+2O
2 (g)=CO
2(g)+2H
2O(g)△H
2=-890.3kJ?molˉ
1③CH
4(g)+CO
2 (g)=2CO (g)+2H
2(g)△H
3=247.3kJ?molˉ
1试结合反应①,确定下面热化学反应方程式中的△H值
CH
4(g)+H
2O (g)=CO (g)+3H
2(g)△H=______kJ?molˉ
1(2)恒温下,向一个2L的密闭容器中充入1mol N
2和2.6mol H
2,反应过程中对NH
3的浓度进行检测,得到的数据如下表所示:
| 时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
| c(NH3)/( mol?Lˉ1) |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
此条件下,该反应达到化学平衡时,氮气的浓度为______.
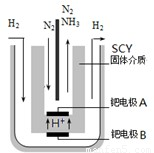
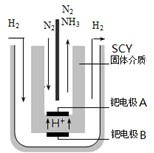
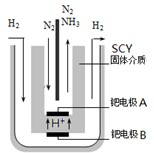
(3)希腊亚里斯多德大学的Marmellos和Stoukides用一种特殊的电解方法合成氨.即在常压下把氢气和用氦气稀释的氮气,分别通入到570℃的电解池中,用高质子导电性的SCY陶瓷(能传递H
+)为介质,金属钯多晶薄膜做电极,转化率高达78%.其实验装置如右图.阴极的电极反应式______.
(4)用标准盐酸标定某氨水的浓度时应该选择下列哪种指示剂最好______.
A.甲基橙 B.石蕊 C.酚酞
(Ⅱ) pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值,如溶液中某溶质的浓度为:1×10ˉ
3mol?Lˉ
1,则pC=-lg(1×10ˉ
3)=3.某温度下,H
2CO
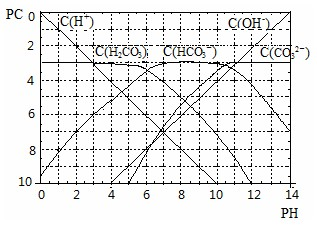
3溶液的pC-pH关系如图.
请回答下列问题:
(1)pH=2~4时,H
2CO
3溶液中主要存在的离子为______;
(2)求此温度下H
2CO
3 
H
++HCO
3ˉ 的电离平衡常数______;
(3)能够抵抗外来少量酸碱的影响、保持自身 pH变化不大的溶液,称之为缓冲溶液.如浓度均为0.1mol?Lˉ
1的NaHCO
3和Na
2CO
3混合溶液就是一种缓冲溶液,加入少量酸或碱,由于平衡HCO
3ˉ

H
++CO
32ˉ移动,溶液中H
+浓度变化不大.根据上述信息,确定氨水和氯化铵的混和溶液能不能形成缓冲溶液______.





 此条件下,该反应达到化学平衡时,氮气的浓度为
此条件下,该反应达到化学平衡时,氮气的浓度为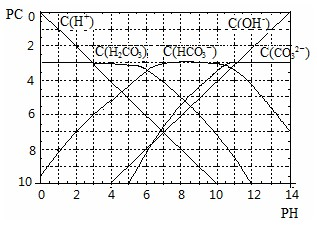

 H++HCO3ˉ 的电离平衡常数 ;
H++HCO3ˉ 的电离平衡常数 ; H++CO32ˉ移动,溶液中H+浓度变化不大.根据上述信息,确定氨水和氯化铵的混和溶液能不能形成缓冲溶液 .
H++CO32ˉ移动,溶液中H+浓度变化不大.根据上述信息,确定氨水和氯化铵的混和溶液能不能形成缓冲溶液 .