
题目列表(包括答案和解析)
| 实验次数 | H2O2溶液质量分数% | H2O2溶液用量/毫升 | 物质D用量/克 | 反应温度/℃ | 收集气体体积/毫升 | 所需时间/秒 |
| ① | 30 | 5 | 0 | 85 | 2 | 3.8 |
| ② | 15 | 2 | 0.1 | 20 | 2 | 2.8 |
| ③ | 15 | 2 | 0.2 | 20 | 2 | 2.2 |
| ④ | 5 | 2 | 0.1 | 20 | 2 | 7.4 |
| ⑤ | 30 | 5 | 0 | 55 | 2 | 10.5 |
| ||
| △ |
| ||
| ||
| △ |
| ||
(14分)草酸是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸。某学习小组的同学拟以甘蔗渣为原料用水解—氧化—水解循环进行制取草酸。
|
 请跟据以上信息回答下列问题:
请跟据以上信息回答下列问题:草酸是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸。某学习小组的同学拟以甘蔗渣为原料用水解—氧化—水解循环进行制取草酸。



请跟据以上信息回答下列问题:
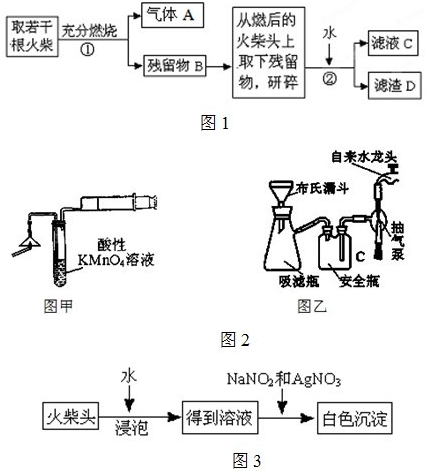
⑴图示①②的氧化—水解过程是在上图1的装置中进行的,指出装置A的名称 。
⑵图示①②的氧化—水解过程中,在硝酸用量、反应的时间等条件均相同的情况下,改变反应温度以考察反应温度对草酸收率的影响,结果如上图2所示,请选择最佳的反应温度为 ,为了达到图2所示的温度,选择图1的水浴加热,其优点是 。
⑶在图示③④中的操作涉及到抽滤,洗涤、干燥,下列有关说法正确的是 。
A.在实验过程中,通过快速冷却草酸溶液,可以得到较大的晶体颗粒,便于抽滤
B.在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
C.为了检验洗涤是否完全,应拔下吸滤瓶与安全瓶之间橡皮管,从吸滤瓶上口倒出少量滤液于试管中进行相关实验。
D.为了得到干燥的晶体,可以选择在坩埚中直接加热,并在干燥器中冷却。
⑷要测定草酸晶体(H2C2O4·2H2O)的纯度,称取7.200g制备的草酸晶体溶于适量水配成250mL溶液,取25.00mL草酸溶液于锥形瓶中,用0.1000mol/L酸性高锰酸钾溶液滴定
(5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O),
①取25.00mL草酸溶液的仪器是 。
②在草酸纯度测定的实验过程中,下列说法正确的是: 。
A.润洗滴定管时,应从滴定管上口加满所需的酸或碱液,使滴定管内壁充分润洗
B.移液管取草酸溶液时,需将尖嘴处的液体吹入锥形瓶,会使实验误差偏低
C.滴定时,左手轻轻向内扣住活塞,手心空握以免碰到活塞使其松动漏出溶液
D.滴定终点读取滴定管刻度时,仰视标准液液面,会使实验误差偏高
③判断滴定已经达到终点的方法是: 。
④达到滴定终点时,消耗高锰酸钾溶液共20.00mL,则草酸晶体的纯度为 。
草酸是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸。某学习小组的同学拟以甘蔗渣为原料用水解—氧化—水解循环进行制取草酸。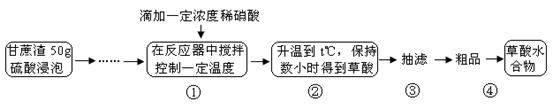
|
|
 请跟据以上信息回答下列问题:
请跟据以上信息回答下列问题:芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸 。反应原理:

反应试剂、产物的物理常数:
名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
水 | 乙醇 | 乙醚 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | ∞ | ∞ |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
主要实验装置和流程如下:

图1回流搅拌装置 ???? ???????????????? 图2抽滤装置
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在100℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。

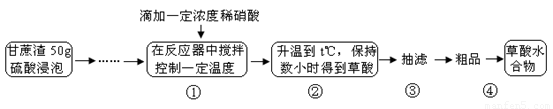
(1)仪器K的名称为????? 。无色液体A的结构简式为????? 。操作Ⅱ为????? 。
如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是????? 。
(3)下列关于仪器的组装或者使用正确的是????? 。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌棒下端不能与三颈烧瓶底、温度计等接触
C.抽滤结束后,为防止倒吸,应先关闭水龙头,再断开真空系统与过滤系统的连接
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入????? ,分液,水层再加入????? ,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100ml溶液,取其中25.00ml溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为????? 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com