
题目列表(包括答案和解析)
| 时间/s | 1 | 2 | 3 | 4 | 5 | |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(12分)欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
物质 n/mol T/℃ |
活性炭 |
NO |
E |
F |
|
初始 |
2.030 |
0.100 |
0 |
0 |
|
T1 |
2.000 |
0.040 |
0.030 |
0.030 |
|
T2 |
2.005 |
0.050 |
0.025 |
0.025 |
①请结合上表数据,写出NO与活性炭反应的化学方程式 。
②根据上述信息判断,温度T1和T2的关系是(填序号) 。
a.T1>T2 b.T1<T2 c.无法比较
(3)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质, CO 为阳极燃气,空气与 CO2 的混和气为阴极助燃气,制得在 650 ℃下工作的燃料电池,其阳极反应式:2CO + 2CO32- =4CO2 +4e- 则 阴极反应式: ,电池总反应式: 。
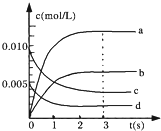 ( I)在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的交化如下表:
( I)在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的交化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| c2(NO2) |
| c2(NO)?c(O2) |
| c2(NO2) |
| c2(NO)?c(O2) |
| ||
| ||
| ||
| ||
化工行业的发展必须符合国家节能减排的总体要求。请回答下列问题:
(1)已知C(s)+H2O(g) CO(g)+H2(g),则该反应的平衡常数表达式为 。
CO(g)+H2(g),则该反应的平衡常数表达式为 。
(2)已知在一定温度下,
C(s)+CO2(g)  2CO(g) △H1
2CO(g) △H1
CO(g)+H2O(g) 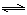 H2(g)+CO2(g) △H2
H2(g)+CO2(g) △H2
C(s)+H2O(g)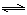 CO(g)+H2(g) △H3
CO(g)+H2(g) △H3
则△H1、△H2、△H3之间的关系是: 。
(3)通过研究不同温度下平衡常数可以解决某些实际问题。已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应: CO(g)+H2O(g) 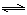 H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
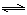 2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :
2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :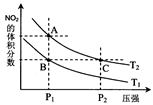

化工行业的发展必须符合国家节能减排的总体要求。请回答下列问题:
(1)已知C(s)+H2O(g)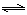 CO(g)+H2(g),则该反应的平衡常数表达式为 。
CO(g)+H2(g),则该反应的平衡常数表达式为 。
(2)已知在一定温度下,
C(s)+CO2(g)
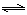 2CO(g)
△H1
2CO(g)
△H1
CO(g)+H2O(g)
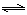 H2(g)+CO2(g)
△H2
H2(g)+CO2(g)
△H2
C(s)+H2O(g)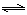 CO(g)+H2(g) △H3
CO(g)+H2(g) △H3
则△H1、△H2、△H3之间的关系是: 。
(3)通过研究不同温度下平衡常数可以解决某些实际问题。已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应: CO(g)+H2O(g) 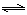 H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
则该反应的正反应方向是 反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g) 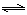 2NO2(g)
△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :
2NO2(g)
△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :
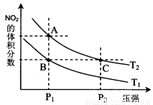
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
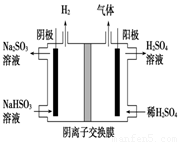
(5)工业上用Na2SO3吸收尾气中的SO2,再用下图装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为: ,阳极区逸出气体的成分为 (填化学式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com