
题目列表(包括答案和解析)
(Ⅰ)化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是________
A.定性检验SO32-,可用HNO3酸化的BaCl2溶液
B.配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度
C.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液
(Ⅱ)离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有________(填编号).
①单质
②氧化物
③电解质
④盐
⑤化合物
(2)一种无色透明溶液中
,可能含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、HSO3-、HCO3-、I-和Cl-,取该溶液进行如下实验:①将溶液滴在蓝色石蕊试纸上,呈红色.
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色.
③取少许溶液滴入BaCl2试液,则产生白色沉淀.
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀HNO3的白色沉淀.
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解.
根据以上现象判断,原溶液中肯定不存在的离子是________;肯定存在的离子是________;不能作出判断的离子是________.
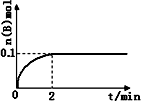
(1)在一定温度下,向1 L体积固定的密闭容器中加入1 mol A(g),发生反应2A(g)![]() B(g)+C(g),B的物质的量随时间的变化如图所示.0-2 min内的平均反应速率v(A)=________.相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时________是原来的2倍.
B(g)+C(g),B的物质的量随时间的变化如图所示.0-2 min内的平均反应速率v(A)=________.相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时________是原来的2倍.
a.平衡常数
b.A的平衡浓度
c.平衡时混合气体的密度
d.平衡时B的体积分数
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大.
a.NaNO3
b.CuSO4
c.Na2SO4
d.NaHSO3
e.CH3COOH
(3)用惰性电极电解Cu(NO3)2溶液一段时间后,加入a mol的Cu(OH)2可使溶液恢复原状,则电解过程中转移的电子数目为________.
(4)已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH=________
(5)已知25℃时,Ksp[Cu(OH)2]=2×10-20,要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为________.
 动(填“向左”、“向右”或“不”).
动(填“向左”、“向右”或“不”).(14分)(1)在一定温度下,向1L体积固定的密闭容器中加入1mol A(g),发生反应2A(g) B(g)+C(g),B的物质的量随时间的变化如图所示。 0—2min内的平均反应速率v(A)= . 相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时 是原来的2倍。
B(g)+C(g),B的物质的量随时间的变化如图所示。 0—2min内的平均反应速率v(A)= . 相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时 是原来的2倍。
a.平衡常数 b. A的平衡浓度
c.平衡时混合气体的密度 d.平衡时B的体积分数
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4
c.Na2SO4 d.NaHSO3
e. CH3COOH
(3)用惰性电极电解Cu(NO3)2溶液一段时间后,加入a mol 的Cu(OH)2可使溶液恢复原状,则电解过程中转移的电子数目为_____________
(4)已知:2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l) △H=_____________
(5)已知25℃时,Ksp[Cu(OH)2]=2×10-20,要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com