
题目列表(包括答案和解析)
| ||
| ||
| ||
| ||
| ||
| ||
(1)(4分)某化学反应,设反应物总能量为E1,生成物总能量为E2。若E1>E2,则该反应为______热反应,该反应的能量转化是_________________________。
(2)(6分)用锌片、铜片和稀盐酸组成的原电池,正极的电极反应是___________________,负极的电极反应是_______________________,原电池的总反应是_________________ ___。
【解析】(1)考查化学反应和能量的变化。若反应物的总能量高于生成物的总能量,则反应是放热反应,反之是吸热反应。在化学反应中化学能大部分转化为热能。
(2)考查原电池中电极反应式的书写。在原电池中较活泼的金属作负极,不活泼的金属作正极。锌比铜活泼,所以锌是负极,失去电子被氧化,发生氧化反应。铜是正极,溶液中的氢离子在正极得到电子,被还原生成氢气。
(12分)
写出下列反应的化学方程式,并指出该反应属于何种反应类型
(1)丙烯通入溴水使溴水退色
(2) 苯和溴单质在铁粉作催化剂条件下反应
(3)工业上由乙炔制聚氯乙烯
__________ ______________
【解析】考查有机反应方程式的书写和有机反应类型的判断。
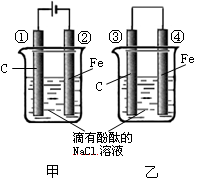
化学能和电能的相互转化,是能量转化的重要方式之一,右图两个实验装置是实现化学能和电能相互转化的装置。

(1)把化学能转化为电能的装置是 (填“甲”或“乙”);
(2)④电极上的电极反应式为
(3)①电极上的电极反应式为 ,
检验该电极反应产物的方法是
(4)写出装置甲的反应总化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com