
题目列表(包括答案和解析)
问题1:设空气中N2、O2的含量分别为0.80和0.20(体积分数),则110 L空气和足量的FeS2完全反应后,气体体积(同温同压)变为 L。
问题2:为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气中的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为了测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
1 | 3.62 | 50.00 | 0.896 |
2 | 7.24 | 50.00 | 1.792 |
3 | 10.86 | 50.00 | 2.016 |
4 | 14.48 | 50.00 | 1.568 |
(1)由1组数据直接推测:用1.81 g样品进行同样实验时,生成氨气的体积(标准状况)为 L。
(2)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为 。
(3)求所用NaOH溶液的物质的量浓度。(写出计算过程)
实验 | 序号样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
1 | 3.62 | 50.00 | 0.896 |
2 | 7.24 | 50.00 | 1.792 |
3 | 10.86 | 50.00 | 2.016 |
4 | 14.48 | 50.00 | 1.568 |
(1)由1组数据直接推测,1.81 g样品进行同样实验时,生成氨气的体积(标况)为________ L。
(2)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为___________。
(3)求所有NaOH溶液的物质的量浓度为___________ mol·L-1。
硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可分为三个阶段:①二氧化硫的制取和净化;②二氧化硫转化为三氧化硫;③三氧化硫的吸收和硫酸的生成。
问题1:设空气中N2、O2的含量分别为0.80和0.20(体积分数),则110 L空气和足量的FeS2完全反应后,气体体积(同温同压)变为L。
问题2:为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气中的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为了测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| 1 | 3.62 | 50.00 | 0.896 |
| 2 | 7.24 | 50.00 | 1.792 |
| 3 | 10.86 | 50.00 | 2.016 |
| 4 | 14.48 | 50.00 | 1.568 |
(1)由1组数据直接推测:用1.81 g样品进行同样实验时,生成氨气的体积(标准状况)为 L。
(2)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为 。
(3)求所用NaOH溶液的物质的量浓度。(写出计算过程)
(18分)硫酸是化学工业最重要的产品之一,工业制法如下。
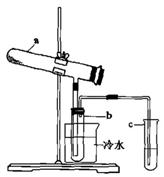
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2OFe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。
①试管b中得到的主要产物是 ,检验该产物的方法是(结合离子方程式简要说明) 。
②为检验反应的另一种生成物,试管c中应加入的试剂是 ,简述相应的实验现象及结论 。
③ 所得硫酸的理论浓度(溶质的质量分数)为 。
(2)目前,我国采用“接触法”制硫酸,生产设备如图所示:
①图中设备A的名称是 ,a、b两处所含气体的化学式分别为 、 。
②有关接触法制硫酸的下列说法中,不正确的是 。
A. 二氧化硫的接触氧化在合成塔中发生
B.吸收塔得到的硫酸浓度为98%
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4%
D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率
(3)随着化学工业的发展,“接触法”全面替代了“绿矾热分解法”,请你从综合效益的角度指出“接触法”制硫酸的优势:① 生产成本低、② 原料易得、③ 、④ 、⑤ 、⑥ (可不填满)。
(18分)硫酸是化学工业最重要的产品之一,工业制法如下。
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管
Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管 。
。
①试管b中得到的主要产物是 ,检验该产物的方法是(结合离子方程式简要说明) 。
②为检验反应的另一种生成物,试管c中应加入的试剂是 ,简述相应的实验现象及结论 。
③所得硫酸的理论浓度(溶质的质量分数)为 。
(2)目前,我国采用“接触法”制硫酸,生产设备如图所示: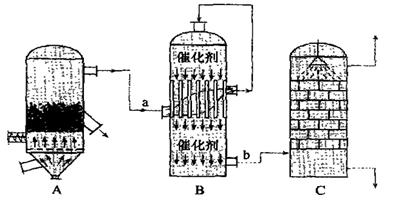
①图中设备A的名称是 ,a、b两处所含气体的化学式分别为 、 。
②有关接触法制硫酸的下列说法中,不正确的是 。
| A.二氧化硫的接触氧化在合成塔中发生 |
| B.吸收塔得到的硫酸浓度为98% |
| C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4% |
D. B装置中反应的条件之一为较高温度是为了提高SO2的转化率 B装置中反应的条件之一为较高温度是为了提高SO2的转化率 |
 、⑤ 、⑥ (可不填满)。
、⑤ 、⑥ (可不填满)。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com