
题目列表(包括答案和解析)
 的值________(填“增大”、“减小”或“不变”).
的值________(填“增大”、“减小”或“不变”). 常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③HCl溶液 ④氨水
(1) 上述溶液中,可发生水解的是_______ _(填序号,下同)。
(2) 上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为________________________________________________________________。
(3) 向④中加入少量氯化铵固体,此时c(NH![]() )/c(OH-)的值________(填“增大”、“减小”或“不变”)。
)/c(OH-)的值________(填“增大”、“减小”或“不变”)。
(4) 若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________。
(5) 取10 mL溶液③,然后加水稀释到500 mL,则此时溶液中由水电离出的
c(H+)=________ 。
常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3
②NaHCO3
③HCl
④NH3?H2O
(1)上述溶液中,可发生水解的是________(填序号,下同).
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度大到小的顺序为________.
(3)向溶液④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值________(填增大、减小、不变).
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填大于、小于、等于).
(5)取10 mL溶液③,加水稀释到500 mL,则该溶液中由水电离出的c(H+)=________.
(1)常温下将0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略溶液体积的变化),测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)________HCl溶液中由水电离出的c(H+)(填“>”、“<”或“=”)。
(2)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH________(填“>7”、“<7”或“无法确定”)。
(3)常温下测得浓度为0.1mol·L-1的HA溶液的pH=3,则HA的电离常数Ka=
 (4)工业上用氯化铁溶液腐蚀铜制电路板。如下图,横坐标为溶液pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol/L时,可认为沉淀完全)。试回答下列问题
(4)工业上用氯化铁溶液腐蚀铜制电路板。如下图,横坐标为溶液pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol/L时,可认为沉淀完全)。试回答下列问题
①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1 mol/L,
今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金
属阳离子为_____________。
②从图中数据计算可得Fe(OH)2的溶度积:
Ksp[Fe(OH)2]=___________。
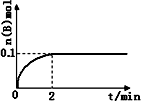
(1)在一定温度下,向1 L体积固定的密闭容器中加入1 mol A(g),发生反应2A(g)![]() B(g)+C(g),B的物质的量随时间的变化如图所示.0-2 min内的平均反应速率v(A)=________.相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时________是原来的2倍.
B(g)+C(g),B的物质的量随时间的变化如图所示.0-2 min内的平均反应速率v(A)=________.相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时________是原来的2倍.
a.平衡常数
b.A的平衡浓度
c.平衡时混合气体的密度
d.平衡时B的体积分数
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大.
a.NaNO3
b.CuSO4
c.Na2SO4
d.NaHSO3
e.CH3COOH
(3)用惰性电极电解Cu(NO3)2溶液一段时间后,加入a mol的Cu(OH)2可使溶液恢复原状,则电解过程中转移的电子数目为________.
(4)已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH=________
(5)已知25℃时,Ksp[Cu(OH)2]=2×10-20,要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com