
题目列表(包括答案和解析)
已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。现有含FeClx杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:

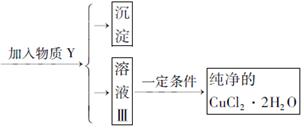
请回答下列问题:
(1)本实验最适合的氧化剂X是__________。(选填下面的序号)
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y是________。
(3)本实验用加碱沉淀的目的是否能达到?________________。原因是________________。
(4)除去Fe3+的化学方程式为________________________________。
(5)加氧化剂的目的为________________________。
(6)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________________。原因是________。
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工原料。某研究小组用粗铜(含杂质Fe) 按下述流程制备氯化铜晶体(CuCl2·2H2O)。

⑴实验室采用如右图所示的装置,可将粗铜与Cl2反应转化为固体
1(部分仪器和夹持装置已略去)。
①仪器A的名称是_________________。
②装置B中发生的反应的离子方程式是
__________________________________。
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要______(填“是”或“否”)。
⑵试剂X用于调节pH以除去杂质,X可选用下列试剂中的_________(填序号)。
a.NaOH b.NH3·H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
⑶在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色,小组同学欲探究其原因。已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq) CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K=________________________,若增大氯离子浓度,K值_________(填“增大”、 “减小”或“不变”)。
②取氯化铜晶体配制蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是___________(填序号)。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
铁铜单质及其化合物的应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按照如图步骤进行提纯:
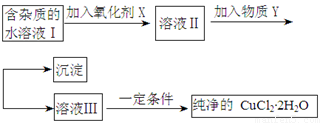
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
|
|
Fe3+ |
Fe2+ |
Cu2+ |
|
氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
|
氢氧化物沉淀完全时的pH |
3.2 |
9.0 |
6.7 |
请回答下列问题:
(1)加入氧化剂的目的是
(2)下列最适合作氧化剂X的是
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y是
(4)如果不用物质Y而直接用可溶性碱溶液能不能达到目的? (填“能”或者“不能”)。若不能,试解释原因 (若填“能”,此空不用回答)
(5)最后能不能直接蒸发得到CuCl2·2H2O? (填“能”或者“不能”)。若不能,应该如何操作才能得到CuCl2·2H2O (若填“能”,此空不用回答)
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是
(7)若向溶液Ⅱ中加入镁粉,产生的气体是 ,试解释原因
(8)FeCl3溶液具有净水作用的原因是
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工原料。某研究小组用粗铜(含杂质Fe) 按下述流程制备氯化铜晶体(CuCl2·2H2O)。
⑴实验室采用如右图所示的装置,可将粗铜与Cl2反应转化为固体
1(部分仪器和夹持装置已略去)。
①仪器A的名称是_________________。
②装置B中发生的反应的离子方程式是
__________________________________。
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要______(填“是”或“否”)。
⑵试剂X用于调节pH以除去杂质,X可选用下列试剂中的_________(填序号)。
a.NaOH b.NH3·H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
⑶在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色,小组同学欲探究其原因。已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq)CuCl42-(aq)+4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K=________________________,若增大氯离子浓度,K值_________(填“增大”、 “减小”或“不变”)。
②取氯化铜晶体配制蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是___________(填序号)。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
已知金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH。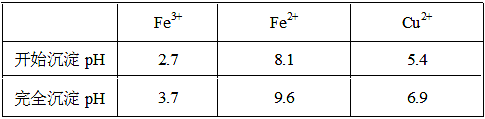
(1)实验室配制FeCl2溶液时需加入少许盐酸和铁粉,若只加盐酸、不加铁粉,溶液中会发生什么变化,用离子方程式表示为: ;
(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。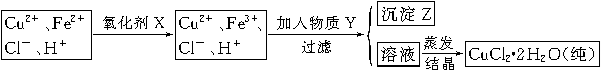
①加氧化剂X的目的是 ,下列氧化剂中最适合作氧化剂X的是 (填序号);
| A.NaClO | B.H2O2 | C.KMnO4 | D.HNO3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com