
题目列表(包括答案和解析)
现有H2SO4和Na2SO4混合溶液200 mL,其中硫酸的物质的量浓度为1 mol·L-1,硫酸钠的物质的量浓度为0.5 mol·L-1.若要使硫酸和硫酸钠的物质的量浓度分别为2 mol·L-1和0.2 mol·L-1,应加入质量分数为55.8%的硫酸溶液(ρ=1.35 g·mL-1)多少毫升后再加蒸馏水配制?
(1)已知:
Fe(s)+1/2O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
2Al(s)+3/2O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
Al和FeO发生铝热反应的热化学方程式是________.
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如下图所示.
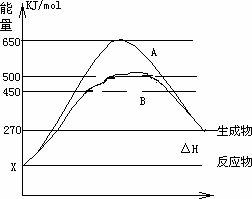
①
据图判断该反应是________(填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率________(填“增大”、“减小”或“不变”)②
其中B历程表明此反应采用的条件为________(选填下列序号字母)A.升高温度
B.增大反应物的浓度
C.降低温度
D.使用了催化剂
(3)1000℃
时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g)①该反应的平衡常数表达式为________.已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”).
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性________
(4)常温下
,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:①
混合溶液中水电离出的c(H+)与0.1 mol·L-1 NaOH溶液中水电离出的c(H+)比较________(填<、>、=).②
已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填<、>、=);相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为________.(填序号)a.NH4HCO3
b.NH4A
c.(NH4)2CO3
d.NH4Cl
(1)已知:
①Fe(s)+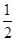 O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
②2Al(s)+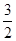 O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
Al和FeO发生铝热反应的热化学方程式是____________________________________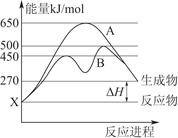
(2)某可逆反应在不同条件下的反应历程分别为A、B(如上图所示)。
①根据图判断该反应达到平衡后,其他条件不变,升高温度,反应物的转化率________(填“增大”“减小”或“不变”);
②其中B历程表明此反应采用的条件为________(选填序号)。
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
(3)1000 ℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)
该反应的平衡常数表达式为________________________________;
已知K1000 ℃<K1200 ℃,若降低体系温度,混合气体的平均相对分子质量将会________(填“增大”“减小”或“不变”)。
(4)常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1 mol·L-1 NaOH溶液中由水电离出的OH-浓度之比为________;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“<”“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号)________。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:![]()
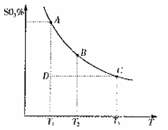
![]() 混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
 ①
①![]() 的△H 0(填“>”
的△H 0(填“>”
或“<”);若在恒温、恒压条件下向上述平衡体系中 通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,
则K1 K2;反应进行到状态D时,V正 v逆
(填“>”、“<”或“=)
 (2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
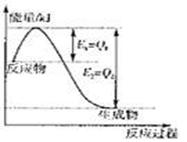
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: 。(△H的数值用含字母Q1、Q2的代数式表示)
②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与
b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则:
c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示该混合溶液中一水合出氨的电离平衡常数表达式 。
(3)1000℃时,硫酸钠与氢气发生下列反应:
Na2SO4(s) + 4H2(g) ![]() Na2S(s) + 4H2O(g) 。
Na2S(s) + 4H2O(g) 。
①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性
(4)25℃时,已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为 。(填序号)
a..NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(1)实验室里有已配制好的NaOH溶液,一瓶所贴标签为6 mol·L-1,另一瓶所贴标签为12%(密度为1.12 g·mL-1).则12%的NaOH溶液的物质的量浓度为________.
(2)在50 mL NaNO3和Na2SO4的混合溶液中,c(Na+)=1 mol/L,往其中加入50 mL BaCl2溶液恰好完全反应,得到2.33 g白色沉淀,则原混合溶液中c(NO3-)=________.
(3)实验室里常用KMnO4与浓盐酸反应制取少量氯气,其化学方程式为:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
1、用双桥式表示电子转移的方向和数目.
2、产生标况下11.2 L Cl2,则被氧化的HCl的物质的量为________摩.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com