(2013?天津)FeCl
3在现代工业生产中应用广泛.某化学研究性学习小组模拟工业流程制备无水FeCl
3,再用副产品FeCl
3溶液吸收有毒的H
2S.
Ⅰ.经查阅资料得知:无水FeCl
3在空气中易潮解,加热易升华.他们设计了制备无水FeCl
3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
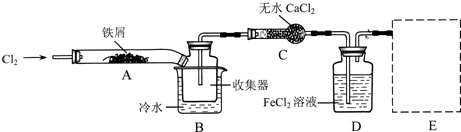
①检验装置的气密性:
②通入干燥的Cl
2,赶尽装置中的空气;
⑨用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl
2,并用干燥的N
2赶尽Cl
2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为
.
(2)第③步加热后,生成的烟状FeCl
3大部分进入收集器,少量沉积在反应管A右端.要使沉积的FeCl
3进入收集器,第④步操作是
在沉积的FeCl3固体下方加热
在沉积的FeCl3固体下方加热
.
(3)操作步骤中,为防止FeCl
3潮解所采取的措施有(填步骤序号)
②⑤
②⑤
.
(4)装置B中冷水浴的作用为
冷却,使FeCl3沉积,便于收集产品
冷却,使FeCl3沉积,便于收集产品
;装置C的名称为
干燥管
干燥管
;装置D中FeCl
2全部反应后,因失去吸收Cl
2的作用而失效,写出检验FeCl
2是否失效的试剂:
KMnO4溶液
KMnO4溶液
.
(5)在虚线框中画出尾气吸收装置E并注明试剂.
Ⅱ.该组同学用装置D中的副产品FeCl
3溶液吸收H
2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液.
(6)FeCl
3与H
2S反应的离子方程式为
2Fe3++H2S=2Fe2++S↓+2H+
2Fe3++H2S=2Fe2++S↓+2H+
.
(7)电解池中H
+在阴极放电产生H
2,阳极的电极反应式为
Fe2+-e-=Fe3+
Fe2+-e-=Fe3+
.
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H
2S的原子利用率为100%;②
FeCl3得到循环利用
FeCl3得到循环利用
.

