氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
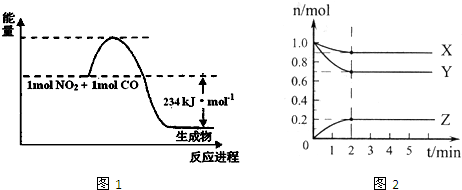
(1)如图1是1mol NO
2和1mol CO反应生成CO
2和NO过程中能量变化示意图(图中涉及物质均为气态),请写出NO
2和CO反应的热化学方程式
NO2(g)+CO(g)=CO2(g)+NO(g);△H=-234kJ?mol-1
NO2(g)+CO(g)=CO2(g)+NO(g);△H=-234kJ?mol-1
.
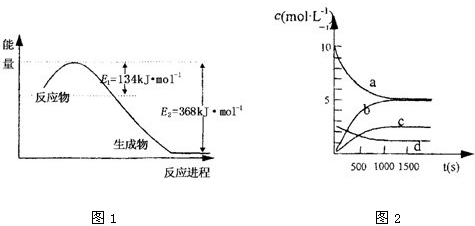
(2)在0.5L的密闭容器中,充入一定量的氮气和氢气进行反应,三种气体的物质的量随时间的变化曲线如图2所示.则Y是
H2
H2
,2min内N
2的反应速率υ(N
2)=
0.1mol?L-1?min-1
0.1mol?L-1?min-1
.
(3)硝酸工业在国民经济、国防工业和航天事业中占有重要地位.随着化学纤维、近代有机合成、火箭、导弹等工业的迅速发展,需要使用大量的硝酸.
①工业生产中用铂系金属作为催化剂,用氨氧化法制取硝酸.第一步反应为氨在催化剂作用下与氧气发生反应生成NO,写出反应化学方程式
.
②铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO
3→Cu(NO
3)
2+NO↑+NO
2↑+H
2O (方程式未配平).反应中还原产物是
NO和NO2
NO和NO2
,0.6mol Cu被硝酸完全溶解后,如果得到的NO和NO
2物质的量相同,则得到标准状况下气体体积为
13.44
13.44
L.

 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题: 2NH3(g)△H<0,其化学平衡常数K与t的关系如下表:
2NH3(g)△H<0,其化学平衡常数K与t的关系如下表: N2(g)+3H2(g)的化学平衡常数的值为
N2(g)+3H2(g)的化学平衡常数的值为

 2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=
2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=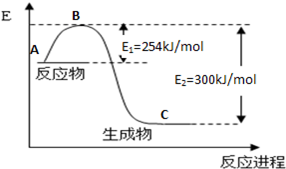 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,