
题目列表(包括答案和解析)

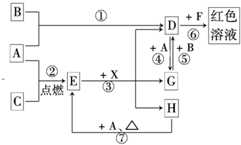 (2012?石景山区一模)A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X、Y均为化合物,其中X是一种无氧强酸、E为黑色晶体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).
(2012?石景山区一模)A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X、Y均为化合物,其中X是一种无氧强酸、E为黑色晶体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).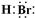
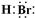

| 加热 |
| 加热 |
(10分)已知A,B,C均为常见的单质,其中A为金属单质,B.C为非金属单质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略)。
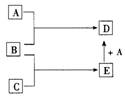
请回答下列问题:
(1)若常温下B.C均为气体,D是磁性晶体,则E的电子式为___ _____,A和E在一定条件下反应生成D的化学方程式为_________ ______。
(2)若常温下B为气体,C为黑色固体,则A的原子结构示意图为 ,
E的结构式为___ _____,A和E在一定条件下反应生成D的化学方程式为______________________ __。
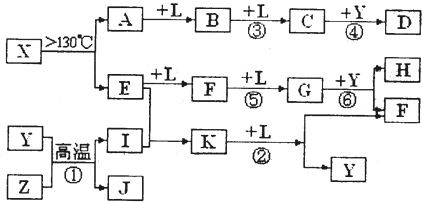
(10分)已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体;Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁性氧化铁,D、H、K均是重要的化工产品;X是结构有待探究的一种新型分子,其组成元素的相对原子质量相差18,下列框图中部分反应条件已略去。
试回答下列问题:
(1)E的结构式为___________,在反应①、②、③、④、⑤、⑥中属于非氧化还原反应的是___________。(填序号)
(2)写出反应②的化学方程式:_________________________________________
(3)若有G、F的混合气体通入足量烧碱溶液,气体全部被吸收,则气体G、F的物质的量之比应满足n(G)︰n(F)____________________
(4)J与过量H的稀溶液反应的离子方程式为___________________________________。
(5)t℃时,将2molE和1mol I通入体积为2L的恒温密闭容器中发生反应,2min后达到平衡n(K)=0.2mol, 此时保持温度不变,体积减半,则E的体积分数如何变化____________(填“增大”、“不变”、“变小”)
第Ⅰ卷(选择题,共45分)
题号
1
2
3
4
5
6
7
8
答案
B
A
D
B
C
D
A
D
题号
9
10
11
12
13
14
15

答案
B
C
C
D
B
A
C

第Ⅱ卷(非选择题,共55分)
二.(本大题包括2小题,计14分)
16.(8分)(1)变大(1分) 变小 (1分)
(2)NH4Cl(2分)NH3?H2O(2分)c(NH4+)=c(Cl-)>c(H+)=c(OH-)(2分)
17.(6分)(1)2NH3 NH4
NH4 +
NH2
+
NH2 (2分)
(2分)
(2)AE(2分)
(3)Al3+(2分)
三.(本大题包括2小题,计18分)
18.(10分)(1)  (2分)
(2分)  (2分)
(2分)
(2)Mg (2分)O=C=O(2分) 2Mg+CO2
(2分)O=C=O(2分) 2Mg+CO2 2MgO+C (2分)
2MgO+C (2分)
19.(8分)(1)三角锥型(2分)
(2) Al-3e-=Al3+或Al-3e-+30H-=Al(0H)3(2分) 02+4e-+2H20=40H- (2分)
(3) Al(0H)3+0H-=AlO2-+2H20(2分)
四.(本大题包括2小题,计23分)
20.(10分)(1)O22-+H2O HO2-+OH-(2分)
HO2-+OH-(2分)
(2) H2O2 (2分)
(3)HO2-+H+= H2O2 2H2O2 2H2O+O2↑(各2分,合理答案参照给分)
2H2O+O2↑(各2分,合理答案参照给分)
(4)B(2分)
21.(13分)(1)Cu在Cl2中燃烧生成棕色烟(2分)
(2)Fe在冷浓硝酸中发生钝化(2分)3:1(2分)
(3)①试管内出现红棕色气体或铜片表面有气泡生成(2分)
②Fe和硝酸反应后的溶液中有HNO3,也一定有Fe3+,而Fe3+也能和Cu反应,使Cu片溶解(2分)
(4)取少许该溶液滴加几滴KSCN溶液,不出现血红色,再滴加适量新制氯水,出现血红色(3分,合理答案参照给分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com