
题目列表(包括答案和解析)


(12分)⑴铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中却生成浅绿色的FeCl2溶液。则在Cl2、Cl-、H+中,具有氧化性的是___________,其中氧化性最强的是_______。
⑵盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下三个反应,请指出盐酸在三个反应中所分别表现的性质:
①Zn+2HCl=ZnCl2+H2↑ ______________________________
②Fe2O3+6HCl=2FeCl3+2H2O ______________________________
③2HCl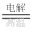 H2↑+Cl2↑
______________________________
H2↑+Cl2↑
______________________________
⑶找出⑵小题中属于氧化还原反应的化学方程式并标出电子转移的方向和数目。
(12分)⑴铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中却生成浅绿色的FeCl2溶液。则在Cl2、Cl-、H+中,具有氧化性的是___________,其中氧化性最强的是_______。
⑵盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下三个反应,请指出盐酸在三个反应中所分别表现的性质:
①Zn+2HCl=ZnCl2+H2↑ ______________________________
②Fe2O3+6HCl=2FeCl3+2H2O ______________________________
③2HCl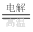 H2↑+Cl2↑ ______________________________
H2↑+Cl2↑ ______________________________
⑶找出⑵小题中属于氧化还原反应的化学方程式并标出电子转移的方向和数目。
(10分)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑,此反应中的氧化剂是 ,还原剂是 (均用化学式填写)。当参加反应的S的质量为48g时,爆炸生成的气体折算成标准状况的体积为 。氧化还原反应的本质是反应中有电子转移,小明同学对这个重要知识点掌握的不是很理想,他很苦恼。请你写出一个你所熟悉的氧化还原反应的方程式,并标出电子转移的方向和数目,帮助小明同学彻底掌握这个知识点。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com