
题目列表(包括答案和解析)
有七种金属:钠、铝、铁、锡、铜、银、金,它们的标号分别为A、B、C、D、E、F、G.
①常温下,只有A和水反应生成氢气;
②D、E、G都能和稀硫酸反应生成氢气;
③D、E、G中只有D与NaOH溶液反应;
④B、F组成原电池时,F为正极;
⑤将G、E组成的合金暴露在潮湿的空气中,经一段时间后,合金的表面有G的化合物出现;
⑥用石墨电极电解含有相同物质的量浓度的B和C两种金属的硝酸盐溶液,B的单质先析出.回答下列问题:
(1)B的元素符号是________;G元素在元素周期表中的位置是________.
(2)D的最高价氧化物与A的最高价氧化物对应水化物发生反应的离子方程式为________.D的单质与G的最高价氧化物发生反应的化学方程式为________,该反应在生产中有重要应用,被称为________反应.
(3)写出⑥中的电极反应式:阳极:________,阴极________.
(4)将C的氯化物溶液蒸干灼烧得到的固体物质是________,原因是________(用必要的文字和离子方程式表示).
(1)氢化钠(NaH)为白色晶体,其中H-有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价,写出其化学反应方程式,并用单线桥标出电子的转移与数目
______________________________________________________________;
NaH能与水剧烈反应NaH +H2O==== NaOH+H2↑,NaH与液氨也有类似反应,
写出反应方程式__________________________________________ 。
(2)有一表面被部分氧化为氧化钠的金属钠试样,欲测其钠的纯度。通过实验可得到下列数据:
①试样的质量为m1g;②水的质量(过量)为m2g;③与水反应过程中生成H2的质量为m3g。
a、求试样钠的纯度,不可能用到的数据是___________(填数据代号)。
![]() b、请根据能测定钠纯度的组合数据,写出计算钠纯度的数学表达式: 。
b、请根据能测定钠纯度的组合数据,写出计算钠纯度的数学表达式: 。
(16分)(1)(6分)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合: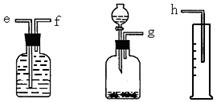
①用接口字母标出各仪器连接的顺序 量筒在实验中的作用是
②有一块表面氧化成Na2O的金属钠,其质量为2.0g,实验后在量筒中收集到0.224L水,求样品中金属钠的质量分数是 。(假设在标准状况下测定)
(2)(10分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
①人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C具有还原性
C.维生素C将Fe3+还原为Fe2+ D.在上述变化中亚硝酸盐是还原剂
②下列方法中,不能用来区分NaNO2和NaCl两种溶液的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
③某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___________________________________。
④ Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
⑤配平下列方程式:
(16分)(1)(6分) 测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:

①用接口字母标出各仪器连接的顺序 量筒在实验中的作用是
②有一块表面氧化成Na2O的金属钠,其质量为2.0g,实验后在量筒中收集到0.224L水,求样品中金属钠的质量分数是 。(假设在标准状况下测定)
(2)(10分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
①人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C具有还原性
C.维生素C将Fe3+还原为Fe2+ D.在上述变化中亚硝酸盐是还原剂
②下列方法中,不能用来区分NaNO2和NaCl两种溶液的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D. 用AgNO3和HNO3两种试剂来区别
③某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___________________________________。
④ Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
⑤配平下列方程式:

 (1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
(1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com