
题目列表(包括答案和解析)
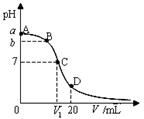
25℃,在20 mL 0.1 mol·L-1氨水溶液中逐滴加入0.1 mol·L-1 HCl溶液,其pH与所加盐酸溶液体积 (V/mL)的关系如图所示,下列说法正确的是( )
A.可以选择酚酞作指示剂
B.在C点,V1<10,且有c(NH4+)=c(Cl—)>c(OH-)=c(H+)
C.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
D. 在D点:c(NH4+)+c(NH3·H2O)=c(Cl—)
某学生用0.1000 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2-3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2-3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2-3 mL处
E.调节液面至“0”或“0”刻度以下,记下读数,为3.10 mL
F.把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点并记下滴定管的读数.
回答下列问题:
(1)正确的操作顺序是:B、________、F(填序号);
(2)上述B步骤操作的目的是________;
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响
是________(填“偏大”或“偏小”或“无影响”);
(4)判断到达滴定终点的实验现象是________;
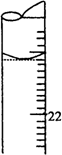
(5)若滴定结束时,滴定管液面如图所示,则终点读数为________mL.
(6)根据读数计算出该待测液的浓度为________.
(15分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol·L-1的标准NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“ 0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
⑥重复以上滴定操作2-3次。
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果_____ (填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00mL待测液应使用__________________(填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果______(填“偏大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视_________________________________;判断到达滴定终点的依据是:______________________________________________________________。
(4)以下是实验数据记录表
| 滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.04 |
| 3 | 20.00 | 0.20 | 16.28 |
从上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,
其可能的原因是( )
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视计数
(5)根据上表记录数据,通过计算可得,该盐酸浓度为: ________mol·L-1
(11分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步: ①用蒸馏水洗涤碱式滴定管,注入0.2000mol·L-1的标准NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
⑥重复以上滴定操作2-3次。
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果_________
(填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00mL待测液应使用__________________(填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果____________(填“大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视 _______________________________判断到达滴定终点的依据是:__________________________________________________。
(4)以下是实验数据记录表
| 滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
从上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是( )
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视计数
(5) 根据上表记录数据,通过计算可得,该盐酸浓度为:____________mol·L-1
(15分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol·L-1的标准NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“ 0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
⑥重复以上滴定操作2-3次。
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果_____ (填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00mL待测液应使用__________________(填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果______(填“偏大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视_________________________________;判断到达滴定终点的依据是:______________________________________________________________。
(4)以下是实验数据记录表
|
滴定次数 |
盐酸体积(mL) |
NaOH溶液体积读数(mL) |
|
|
滴定前 |
滴定后 |
||
|
1 |
20.00 |
0.00 |
18.10 |
|
2 |
20.00 |
0.00 |
16.04 |
|
3 |
20.00 |
0.20 |
16.28 |
从上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,
其可能的原因是( )
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视计数
(5)根据上表记录数据,通过计算可得,该盐酸浓度为: ________mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com