
题目列表(包括答案和解析)
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
| 电离能/kJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
21.A.《物质结构与性质》
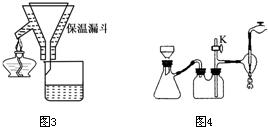
在5-氨基四唑( )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。

⑴基态Ga原子的电子排布式可表示为 ;
⑵5-氨基四唑中所含元素的电负性由大到小的顺序为 ,其中N原子的杂化类型为 ;在1 mol 5-氨基四唑中含有的σ键的数目为 。
⑶叠氮酸钠(NaN3)是传统安全气囊中使用的气体发生剂。
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为 。
②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如右图)顶点的氮原子,这种碳氮化钛化合物的化学式为 。
已知A、B、C、D、E、F、G位于元素周期表的前四周期,且元素原子序数依次增加,A焰色反应呈黄色;工业常用电解B的熔融的氯化物来制备B,C是一种能被HF和NaOH溶液溶解的单质,D的电负性比磷大,第一电离能却比磷小,E单质是制备漂白液的原料,F能形成红色(或砖红色)和黑色的两种氧化物,G是一种主族金属。
(1)前四周期所有元素中,基态原子中未成对电子与其所在周期数相同的元素有 种。
(2)元素A、B、C分别与氟气化合形成物质X、Y、Z熔点见下表:
| 氟化物 | X | Y | Z |
| 熔点/K | 1266 | 1534 | 183 |
(10分) 中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+3C+SA+N2↑+3CO2↑(已配平)
(1)①除S外,上列元素的电负性从大到小依次为______________________。
②在生成物中,A的晶体类型为___,含极性共价键的分子的中心原子轨道杂化类型为____。
③已知CN-与N2为等电子体,推算HCN分子中σ键与π键数目之比为________________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为______,Q2+的未成对电子数是_______。
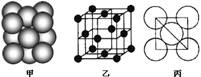
(3)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 .
(4)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R—H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR—H―→Rx[CrCln(H2O)6-n]x++xH+交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R—H完全交换后,中和生成的H+需浓度为0.1200mol·L-1NaOH溶液25.00 mL,可知该配离子的化学式为______,中心离子的配位数为 。
(10分) 中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+3C+SA+N2↑+3CO2↑(已配平)
(1)①除S外,上列元素的电负性从大到小依次为______________________。
②在生成物中,A的晶体类型为___,含极性共价键的分子的中心原子轨道杂化类型为____。
③已知CN-与N2为等电子体,推算HCN分子中σ键与π键数目之比为________________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为______,Q2+的未成对电子数是_______。
(3)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 .
(4)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R—H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR—H―→Rx[CrCln(H2O)6-n]x++xH+交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R—H完全交换后,中和生成的H+需浓度为0.1200mol·L-1NaOH溶液25.00 mL,可知该配离子的化学式为______,中心离子的配位数为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com