
题目列表(包括答案和解析)
(12分)用18 mol/L 的浓硫酸配制100 ml 3.0 mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解
④检漏、 转移、洗涤 ⑤ 定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (用下列编号填空)。
A.10ml B.25ml C.50ml D.100ml)
(2)第③步实验的操作是
(3)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线 ;改用 向容量瓶中滴加蒸馏水至 为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(4)检验试剂瓶中的溶液含有SO42- 的操作是
(5)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
①容量瓶用蒸馏水洗涤后残留有少量的水 ;
②所用过的烧杯、玻璃棒未洗涤 ;
③加水超过刻度线后,用胶头滴管吸出多余的液体 。
(12分)用18 mol/L 的浓硫酸配制100ml 3.0 mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解
④检漏、 转移、洗涤 ⑤ 定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (用下列编号填空)。
A.10ml B.25ml C.50ml D.100ml)
(2)第③步实验的操作是
(3)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线 ;改用 向容量瓶中滴加蒸馏水至 为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(4)检验试剂瓶中的溶液含有SO42- 的操作是
(5)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
①容量瓶用蒸馏水洗涤后残留有少量的水 ;
②所用过的烧杯、玻璃棒未洗涤 ;
③加水超过刻度线后,用胶头滴管吸出多余的液体 。
(12分)用18 mol/L 的浓硫酸配制100 ml 3.0 mol/L 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解
④检漏 、转移、洗涤 ⑤定容、摇匀
、转移、洗涤 ⑤定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (用下列编号填空)。
| A.10ml | B.25ml | C.50ml | D.100ml) |

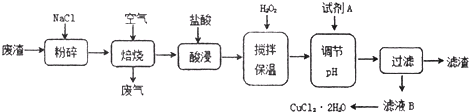
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| c(Ca2+)×c2(HCO3-) |
| c(H2O)×c(CO2) |
| c(Ca2+)×c2(HCO3-) |
| c(H2O)×c(CO2) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com