
题目列表(包括答案和解析)
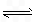 H++A-,则K=
H++A-,则K=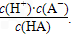 式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度.下表是几种常见弱酸的电离平衡常数(25℃).
式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度.下表是几种常见弱酸的电离平衡常数(25℃). 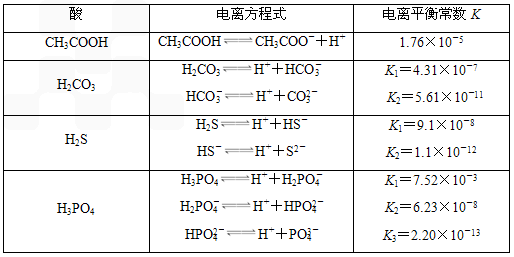
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA![]() H++A―,则K==
H++A―,则K==![]() 式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH | 1.76×10―5 |
| H2CO3 | H2CO3 HCO3― | K1==4.31×10―7 K2==5.61×10―11 |
| H2S | H2S HS― | K1==9.1×10―8
K2==1.1×10―12 |
| H3PO4 | H3PO4 H2PO4― HPO42― |
K1==7.52×10―3 K2==6.23×10―8 K3==2.20×10―13 |
回答下列各题:
(1)K只与温度有关,当温度升高时,K值__________(填“增大”、“减小”、“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?___
__________________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是__________,最弱的是_____________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是________________,产生此规律的原因是_______
____________________________。
| 酸 | 点解方程式 | 电离平衡常数 |
| CH3COOH | CH3COOH?CH3COO-+H+ | K=1.76×10-5 |
| H2CO3 | H2CO3?HCO3-+H+ HCO3-?CO32-+H+ |
K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?HS-+H+ HS-?S2-+H+ |
K1=9.1×10-8 K2=1.1×10-15 |
| H3PO4 | H3PO4?H2PO4-+H+ H2PO4-?HPO42-+H+ HPO42-?PO43-+H+ |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
| cα2 |
| 1-α |
| cα2 |
| 1-α |
| 酸 | 点解方程式 | 电离平衡常数 |
| CH3COOH | CH3COOH?CH3COO-+H+ | K=1.76×10-5 |
| H2CO3 | H2CO3?HCO3-+H+ HCO3-?CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?HS-+H+ HS-?S2-+H+ | K1=9.1×10-8 K2=1.1×10-15 |
| H3PO4 | H3PO4?H2PO4-+H+ H2PO4-?HPO42-+H+ HPO42-?PO43-+H+ | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
A、B、C、D是四种短周期元素,它们的原子序数依次增大.其中A、D元素同主族,B、C元素同周期,由A、B、C、D中的两种元素可形成原子个数比为1∶1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示:
通常状况下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质和丁物质为固体且都为离子化合物.请填写下列空白:
(1)甲物质的结构式为________,丙物质的电子式为________,丁物质中阴离子与阳离子的个数比为________.
(2)若标准状况下5.6 L甲气体完全燃烧生成稳定氧化物时放出的热量为325 kJ,试写出表示甲物质燃烧热的热化学方程式________.
(3)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为________.
一、选择题(每小题3分,共51分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
答案
A
C
C
C
C
C
B
D
A
B
B
D
B
C
A
C
D
二、填空题(21题(1)问每空1分,其余每空2分,共19分)
18.(10分)(1)① (2)①⑤ (3)4 (4)>7 (5)D
19.(8分)(1)

(2)
(3)
 20.(9分)(1)
20.(9分)(1)

 (各1分)
(各1分)
(2)
(3) (4)
(4)

21.(14分)(1)试管上部充满红棕色气体
(2)无; 与水反应生成了足量的
与水反应生成了足量的 ,中和了
,中和了
(3)
 只写第一个给全分
只写第一个给全分
(4) ;
; ;小
;小
22.(8分)(1)
(2)A、D
(3)3 

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com