
题目列表(包括答案和解析)
臭氧可用于净化空气、饮用水的消毒、处理工业废物和作氧化剂.
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s)? ΔH=-235.8kJ/mol.已知2Ag2O(s)=4Ag(s)+O2(g)? ΔH=+62.2kJ/mol,则常温下反应: 2O3(g)=3O2(g)的ΔH=?????????????????????? .
(2)科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-=O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为???????????????????? 。
(3)O3在碱性条件下可将Na2SO4氧化成Na2S2O8。写出该反应的化学方程式为:????????????????????????
 ???????????
??????????? 
(4)所得的Na2S2O8溶液可降解有机污染物4-CP。原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4-·)。通过测定4-CP降解率可判断Na2S2O8溶液产生SO4-·的量。某研究小组设计实验探究了溶液酸碱性、Fe2+的浓度对产生SO4-·的影响。
①溶液酸碱性的影响:其他条件相同,将4-CP加入到不同pH的Na2S2O8溶液中,结果如图a所示。由此可知:溶液酸性增强,???????????????? (填 “有利于”或“不利于”)Na2S2O8产生SO4-·。
②Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4-CP)=1.56×10-4 mol·L-1、c(Na2S2O8)=3.12×10-3 mol·L-1的混合溶液中。反应240 min后测得实验结果如图b所示。已知 S2O82- + Fe2+= SO4-·+ SO42- + Fe3+。则由图示可知下列说法正确的是:_________________(填序号)
A.反应开始一段时间内, 4-CP降解率随Fe2+浓度的增大而增大,其原因是Fe2+能使Na2S2O8产生更多的SO4-·。
B.Fe2+是4-CP降解反应的催化剂
C.当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是Fe2+会与SO4—.发生反应,消耗部分SO4—.。
D.4-CP降解率反而下降,原因可能是生成的Fe3+水解使溶液的酸性增强,不利于降解反应的进行。
③当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解的平均反应速率的计算表达式为??????????????? 。
臭氧可用于净化空气、饮用水的消毒、处理工业废物和作氧化剂.
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s) ΔH=-235.8kJ/mol.已知2Ag2O(s)=4Ag(s)+O2(g) ΔH=+62.2kJ/mol,则常温下反应: 2O3(g)=3O2(g)的ΔH= .
(2)科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-=O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为 。
(3)O3在碱性条件下可将Na2SO4氧化成Na2S2O8。写出该反应的化学方程式为: 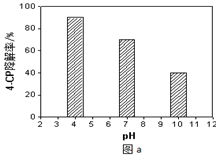

(4)所得的Na2S2O8溶液可降解有机污染物4-CP。原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4-·)。通过测定4-CP降解率可判断Na2S2O8溶液产生SO4-·的量。某研究小组设计实验探究了溶液酸碱性、Fe2+的浓度对产生SO4-·的影响。
①溶液酸碱性的影响:其他条件相同,将4-CP加入到不同pH的Na2S2O8溶液中,结果如图a所示。由此可知:溶液酸性增强, (填 “有利于”或“不利于”)Na2S2O8产生SO4-·。
②Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4-CP)=1.56×10-4 mol·L-1、c(Na2S2O8)=3.12×10-3 mol·L-1的混合溶液中。反应240 min后测得实验结果如图b所示。已知 S2O82- + Fe2+= SO4-·+ SO42- + Fe3+。则由图示可知下列说法正确的是:_________________(填序号)
| A.反应开始一段时间内, 4-CP降解率随Fe2+浓度的增大而增大,其原因是Fe2+能使Na2S2O8产生更多的SO4-·。 |
| B.Fe2+是4-CP降解反应的催化剂 |
| C.当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是Fe2+会与SO4—.发生反应,消耗部分SO4—.。 |
| D.4-CP降解率反而下降,原因可能是生成的Fe3+水解使溶液的酸性增强,不利于降解反应的进行。 |
化学反应原理在科研和生产中有广泛应用。
Ⅰ、如图装置所示,A、B中的电极为多孔的惰性电极;C、D为夹在浸有Na2SO4溶液的滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电。

回答下列问题:
(1) a是电源的 极,写出A中的电极反应式为_____。
(2)湿的Na2SO4滤纸条上能观察到的现象有____________。
(3)电解一段时间后,A、B中均有气体包围电极,若此时切断K2、K3,闭合K1,发现电流表的指针移动,写出此时B中的电极反应式为 。
Ⅱ、甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO(g)+2H2(g)
 CH3OH(g)
ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g)
ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
(4)由表中数据判断ΔH 0(填“>”、“<”或“=”)。
(5)其他条件不变,只改变其中一个条件,下列措施可提高甲醇产率的是 。
A.升高温度;B.使用合适的催化剂;C.缩小容器的容积;D.充入过量的H2;E.恒压时,充入He;F.从体系中分离出CH3OH
(6)某温度下,将2mol CO和6 mol H2充入2L密闭容器中,反应进行到4min末达到平衡,此时测得c(CO) =0.2 mol/L ,则0~4min内H2的反应速率为 ;若保持温度容积不变再向其中充入一定量的CH3OH,重新达到化学平衡状态,与原平衡状态相比,此时平衡混合气体中CH3OH的体积分数 (填“变大”、“变小”、或“不变”)。
化学反应原理在科研和生产中有广泛应用。
Ⅰ、如图装置所示,A、B中的电极为多孔的惰性电极;C、D为夹在浸有Na2SO4溶液的滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电。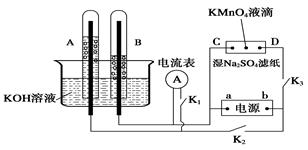
回答下列问题:
(1) a是电源的 极,写出A中的电极反应式为_____。
(2)湿的Na2SO4滤纸条上能观察到的现象有____________。
(3)电解一段时间后,A、B中均有气体包围电极,若此时切断K2、K3,闭合K1,发现电流表的指针移动,写出此时B中的电极反应式为 。
Ⅱ、甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO(g)+2H2(g)  CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com