
题目列表(包括答案和解析)
(12分)氯气是一种重要的工业原料。
Ⅰ.实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 。
Ⅱ.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:
Ca(ClO)2+CaCl2+2H2SO4  2CaSO4+2Cl2↑+2H2O
2CaSO4+2Cl2↑+2H2O
他们利用该反应设计如下制取氯气并验证其性质的实验。
(1)回答下列问题:(1)该实验中A部分的装置是 (填标号) 。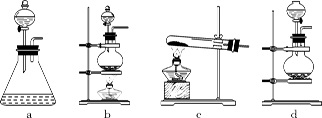
(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤): 。
(3)写出D装置中发生反应的离子方程式 (4)该实验存在明显的缺陷,请你提出改进的方法 。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取出25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol·L?1的Na2S2O3溶液作标准液滴定反应生成的碘,已知反应方程式为:2Na2S2O3+I2 === Na2S4O6+2NaI,共用去Na2S2O3溶液20.0 mL。则该漂白粉中Ca(ClO)2的质量分数为 。
(12分)氯气是一种重要的工业原料。
Ⅰ.实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 。
Ⅱ.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:
Ca(ClO)2+CaCl2+2H2SO4  2CaSO4+2Cl2↑+2H2O
2CaSO4+2Cl2↑+2H2O
他们利用该反应设计如下制取氯气并验证其性质的实验。

(1)回答下列问题:(1)该实验中A部分的装置是 (填标号) 。
(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤): 。
(3)写出D装置中发生反应的离子方程式 (4)该实验存在明显的缺陷,请你提出改进的方法 。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取出25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol·L?1的Na2S2O3溶液作标准液滴定反应生成的碘,已知反应方程式为:2Na2S2O3+I2 === Na2S4O6+2NaI,共用去Na2S2O3溶液20.0 mL。则该漂白粉中Ca(ClO)2的质量分数为 。
(13分)氯气是一种重要的工业原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。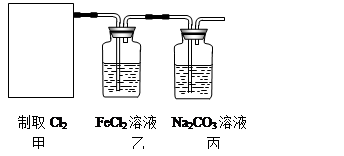
①在该实验中,甲部分的装置是 (填字母)。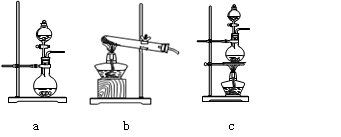
②乙装置中FeCl2溶液与Cl2反应的离子方程式是 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是 。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是 。
④该实验存在明显的缺陷,改进的方法是 。
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0 g漂白粉配制成250 mL溶液,取出25 mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1 mol/L Na2S2O3溶液:2Na2S2O3+I2 ="==" Na2S4O6+2NaI,共消耗20 mL Na2S2O3,则漂白粉中Ca(ClO)2的质量分数为 。
氯气是一种重要的工业原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是:
。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。某学习小组
2CaSO4+2Cl2↑+2H2O。某学习小组
利用此原理设计如图所示装置制取氯气并探究其性质。

①在该实验中,甲部分的装置是 (填字母)。


②乙装置中FeCl2溶液与Cl2反应的离子方程式是 。
证明FeCl2与Cl2发生了氧化还原反应的实验方法是
。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是 。
④该实验存在明显的缺陷,改进的方法是 。
氯气是一种重要的工业原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是:
。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。某学习小组
2CaSO4+2Cl2↑+2H2O。某学习小组
利用此原理设计如图所示装置制取氯气并探究其性质。

①在该实验中,甲部分的装置是 (填字母)。

②乙装置中FeCl2溶液与Cl2反应的离子方程式是 。
证明FeCl2与Cl2发生了氧化还原反应的实验方法是
。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是 。
④该实验存在明显的缺陷,改进的方法是 。
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0 g漂白粉配制成250 mL溶液,取出25 mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1 mol/L Na2S2O3溶液:2Na2S2O3+I2 === Na2S4O6+2NaI,共消耗20 mL Na2S2O3,则漂白粉中Ca(ClO)2的质量分数为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com