
题目列表(包括答案和解析)
肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水.氢气是一种清洁能源,液氢和肼均可用作火箭燃料.
Ⅰ氢气的制取与储存是氢能源利用领域的研究热点.
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=+247.4 kJ·mol-1
(1)氢气作为新能源的优点________.(答2点)
(2)以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________.
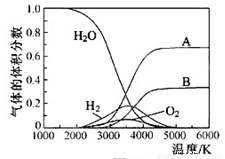
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图所示.图中A、B表示的物质依次是________、________.

Ⅱ(4)肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,负极的电极反应式是________.
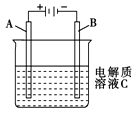
(5)下图是一个电化学装置示意图.用肼一空气燃料电池做此装置的电源.

①如果A是铂电极,B是石墨电极,C是硫酸-硫酸铵,阴极的电极反应式是________.
②利用该装置可制得少量过氧化氢:在阳极上SO42-被氧化成S2O82-(过二硫酸根离子),S2O82-与H2O反应生成H2O2,S2O82-+2H2O=2SO42-+H2O2+2H+.若要制取2 molH2O2,该燃料电池理论上需消耗________molN2H4.
(6)由A、B、C、D四种金属按下表中装置进行实验.
实验装置与现象

根据实验现象回答下列问题:
①装置丙中溶液的PH________.(填“变大”“变小”或“不变”)
②四种金属活泼性由弱到强的顺序是________.
肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,可用作火箭燃料.
(1)写出肼与一氧化氮反应的化学方程式________.
(2)肼——空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.该电池放电时,负极的电极反应式是________________________.
(3)下图是一个电化学装置示意图.用肼——空气燃料电池做此装置的电源.
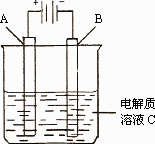
①如果A为含有铁、银、金、碳等杂质的粗铜,B为纯铜,C为CuSO4.通电一段时间后,溶液中Cu2+的浓度将________(填“增大”、“减小”或“不变”).
②如果A是铂电极,B是石墨电极,C是硫酸,阴极的电极反应式是________.利用该装置可制得少量过氧化氢:在阳极上![]() 被氧化成
被氧化成![]() (过二硫酸根离子).
(过二硫酸根离子).![]() 与H2O反应生成H2O2,
与H2O反应生成H2O2,![]()
![]() .若要制取1 mol H2O2,该燃料电池理论上需消耗________mol N2H4.
.若要制取1 mol H2O2,该燃料电池理论上需消耗________mol N2H4.
 肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,用作火箭燃料.(16分)肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水。氢气是一种清洁能源,液氢和肼均可用作火箭燃料。
Ⅰ 氢气的制取与储存是氢能源利用领域的研究热点。
已知: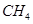 (g)+
(g)+ 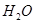 (g)=
(g)=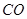 (g)+
(g)+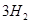 (g)
(g) 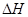 =
+
=
+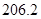

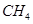 (g)+
(g)+ 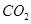 (g)=
(g)=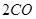 (g)+
(g)+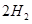 (g)
(g)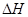 = +
= +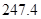

(1)氢气作为新能源的优点 。(答2点)
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。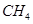 (g)与
(g)与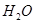 (g)反应生成
(g)反应生成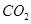 (g)和
(g)和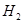 (g)的热化学方程式为
。
(g)的热化学方程式为
。
(3)H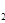 O的热分解也可得到H
O的热分解也可得到H ,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是
、 。
,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是
、 。
Ⅱ(4)肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,负极的电极反应式是 。
(5)下图是一个电化学装置示意图。用肼一空气燃料电池做此装置的电源。
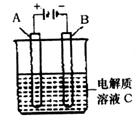
①如果A是铂电极,B是石墨电极,C是硫酸—硫酸铵,阴极的电极反应式是 。
②利用该装置可制得少量过氧化氢:在阳极上SO42—被氧化成S2O82—(过二硫酸根离子),S2O82—与H2O反应生成H2O2,S2O82—+2H2O=2SO42—+H2O2+2H+。若要制取2molH2O2,该燃料电池理论上需消耗 molN2H4。
(6)由A、B、C、D四种金属按下表中装置进行实验。
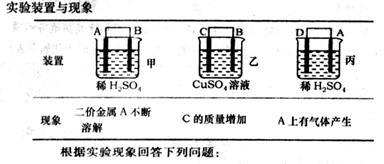
①装置丙中溶液的P H 。(填“变大”“变小”或“不变”)
②四种金属活泼性由弱到强的顺序是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com