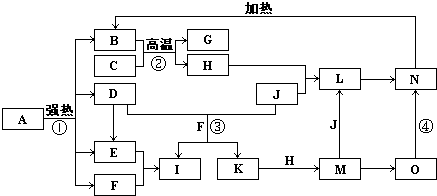
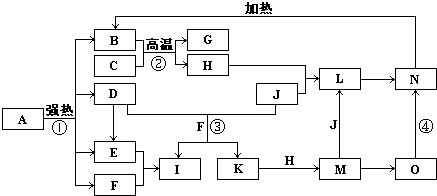
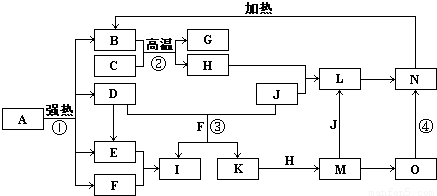
如图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中最常见的金属单质,J是气态非金属单质.O是白色沉淀且B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品(图中部分反应物和生成物没有列出).
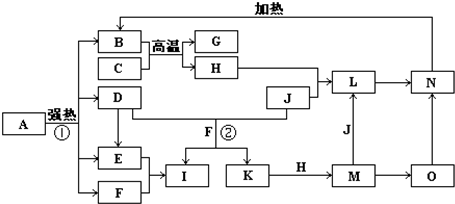
请按要求回答:
(1)写出G、L的化学式G:
Al2O3
Al2O3
,L:
FeCl3
FeCl3
.
(2)反应②的离子方程式
SO2+Cl2+2H2O=4H++SO42-+2Cl-
SO2+Cl2+2H2O=4H++SO42-+2Cl-
.
(3)反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为1:1:1:14,则该反应的化学方程式为
2FeSO
4?7H
2O
Fe
2O
3+SO
2↑+SO
3↑+14H
2O
2FeSO
4?7H
2O
Fe
2O
3+SO
2↑+SO
3↑+14H
2O
.
(4)将A直接溶于水(未加稀硫酸酸化)得到的溶液,敞口久置,变质过程中涉及的离子方程式为
12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓
12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓
.